Techniques innovantes dans le recouvrement des racines dentaires : le concept FASTP
(Fibrin-Assisted Soft-Tissue Promotion concept
Dossier spécial AONews #26 - Juin 2019, Carte blanche à Renaud Petitbois, Président du 5è Congrès Euro-Implanto
Le but de la chirurgie plastique parodontale est la correction des déformations des tissus mous associées à la perte des tissus attachés et kératinisés. La littérature décrit de nombreuses techniques efficaces de manipulation de lambeaux pour les greffes épithélio-conjonctives, mais celles-ci sont caractérisées par une morbidité certaine et des difficultés pour prélever des tissus de qualité, ce qui a incité les cliniciens et les chercheurs à rechercher des approches alternatives. La fibrine riche en plaquettes (A-PRF), qui s’utilise largement en médecine et en chirurgie orale, représente une nouvelle génération de facteurs de croissance dérivés du sang. Cet article décrit une technique simple et reproductible de recouvrement radiculaire à l’aide du concept FASTP.
La chirurgie plastique parodontale joue aujourd’hui un rôle de plus en plus important en parodontologie. Aux Etats-Unis, 90% de la population âgée de 60 ans aura au moins 1 dent avec une récession de 1 mm tandis que 40% de cette même population aura au moins 1 site avec une récession supérieure à 3 mm (1,2). Sans traitement, la récession gingivale progressive aggrave l’état parodontal et peut conduire à des complications dentaires et pulpaires. La chirurgie plastique parodontale ayant pour but le recouvrement radiculaire correspond à une série de techniques permettant la correction des déformations des tissus mous d’origine traumatique ou suite à la présence de plaque. Les objectifs ultimes du recouvrement radiculaire sont la résolution du défaut par un tissu kératinisé et attaché plus épais, la restauration d’un tissu esthétiquement harmonieux, et le rétablissement d’un tissu attaché fonctionnel (3).
Lorsque la récession gingivale implique plusieurs dents adjacentes, un seul traitement chirurgical est indiqué pour gérer tout le secteur en même temps (4). Une greffe de tissu conjonctif prélevée au palais et combinée avec un lambeau pédiculé (lambeau de repositionnement coronaire ou latéral), est une alternative fréquente pour le traitement des récessions gingivales. Des facteurs limitants (par exemple, une quantité insuffisante de tissu conjonctif, refus du patient de subir une deuxième chirurgie, morbidité) ont entraîné l’emploi de substituts pour les tissus conjonctifs autogènes (3,4). En chirurgie plastique parodontale, les greffes allogènes et des xénogreffes sont typiquement utilisés en clinique avec succès comme substituts pour les tissus dermiques. Servant d’échafaudage et permettant la fibroconduction, la nature du tissu attaché obtenu et la quantité de tissu kératinisé sont controversés (4).
Des produits dérivés de la matrice amélaire (EMD) d’origine xénographique utilisés comme agents « boostant » ont donné des résultats cliniques et histologiques positifs lorsqu’ils sont associés avec un lambeau de repositionnement coronaire pour induire une régénération parodontale. Les résultats cliniques sont significatifs seulement en comparaison avec un lambeau de positionnement coronaire utilisé seul (4). Il n’y a pas de preuves en faveur de l’emploi des EMD lorsque des greffes de tissu conjonctif ou des allogreffes sont utilisés comme sites de contrôle. Au cours de la dernière décennie, des modificateurs biologiques dérivés des plaquettes sanguines ont été utilisés pour améliorer la cicatrisation des tissus durs et des tissus mous. Le plasma riche en plaquettes (PRP) représente la première génération de ces « boosters ». Un manque de facteurs de croissance des tissus durs, un protocole compliqué, et une libération rapide expliquent en
partie ses résultats imprévisibles dans la reconstruction des tissus durs et des tissus mous maxillo-faciaux (6). Les résultats obtenus avec l’emploi des PRP pour le recouvrement radiculaire et des chirurgies muco-gingivales sont équivoques.
En 2013, J. Choukroun a introduit les facteurs de croissance d’origine plaquettaire connus sous le nom d’A-PRF (ADVANCED PLATELET-RICH FIBRIN). La facilité d’emploi (une centrifugation unique sans agent anticoagulant), la présence de protéines morphogénétiques osseuses, et des propriétés physiques bénéfiques font de l’A-PRF l’un des facteurs de croissance dérivés des plaquettes sanguines concentrées les plus utilisés aujourd’hui en chirurgie
maxillo-faciale (7).
Cet article présente les bénéfices et les applications cliniques de l’A-PRF en chirurgie plastique parodontale, en particulier pour le recouvrement radiculaire.

Bases fondamentales : PRF et A-PRF
Le PRF (Platelet-Rich Fibrin) est un concentré de plaquettes de deuxième génération préparé à partir d’une seule centrifugation sans ajout d’agent anticoagulant. Le caillot PRF obtenu est une matricephysiologique tridimensionnelle saturée en plaquettes et leucocytes. Les granules alpha secrétés par les plaquettes piégées dans les membranes secrètent leurs facteurs de croissance, permettant une résorption naturelle des membranes à un taux lent (15 jours) (8,9). Les facteurs de croissance suivants sont libérés : PDGF (platelet-derived growth factor), TGK-beta (transforming growth factor beta), VEGF (vascular endothelial growth factor), EGF (epidermal growth factor) et IGF-1 (insulin-like growth factor-1) (8-11).
L'A-PRF (7) est basé sur le même protocole ; cependant, la composition des tubes est différente (en verre, au lieu de plastique, afin d’augmenter l’effet de chélation) (Fig.1) et la durée et la vitesse de centrifugation sont réduites (de 2700 tr/mn / 12 minutes à 1300 tr/mn / 8 minutes). Grâce à la modification de ces deux paramètres, Choukroun et al. (7) ont démontré des taux plus élevés dans l’APRF de VEGF (responsable d’une néo vascularisation rapide), de monocytes (responsable de la libération des BMP), et de la matrice extra cellulaire (fibronectine).
D’après Omar et al. (12) et Rocher et al. (13), les monocytes sont une source importante de BMP-2 (bone morphogenetic protein-2) et de BMP-7 (bone morphogenetic protein-7), ce qui fait que l’A-PRF est un facteur de croissance concentré plaquettaire meilleur et plus puissant que le PRF.
Application parodontale du PRF / A-PRF : Etudes in vitro
Tsai et al. (14) ont étudié les effets biologiques du PRF sur les fibroblastes gingivaux humains, les cellules du ligament parodontale, les cellules épithéliales orales, et les ostéoblastes. En culture cellulaire, la prolifération cellulaire a été stimulée par le PRF (augmentation de 20%) tandis que la prolifération de l’endothélium (en raison de l’emploi de TGF-beta) a été réduite. Ceci suggère que les membranes PRF pourraient être bénéfiques pour la régénération du parodonte. He et al. (15) ont étudié les effets du PRF sur l’adhésion, la prolifération et la phosphorylation cellulaire à l’aide d’ostéoblastes humains. Le PRF était capable d’augmenter l’adhésion et la prolifération des ostéoblastes tout en activant la production de « collagen-related protein » (protéine liée au collagène), ce qui pourrait promouvoir la régénération osseuse.
Les travaux de Kang et al. (16) soutiennent le rôle unique du PRF en tant qu’échafaudage et réservoir de facteurs de croissance pour la régénération tissulaire. Un extrait de PRF (PRFe) augmente la prolifération et la migration et favorise la différentiation des cellules souches alvéolaires humaines. De plus, la transplantation de PRF fraiche dans la calotte crânienne de souris a amélioré la régénération du défaut de taille critique. Dans l’étude de Chang et Zhao (17), l’activation par PRF a entraîné l’expression de la protéine-kinase (p-ERK) et l’ostéoprotégérine (OPG) phosphorylés à régulation de signal extracellulaire, preuve de ses actions bénéfiques pour la régénération osseuse. De plus, Huang et al. (18) ont démontré que le PRF stimule la prolifération et la différentiation des cellules dentaires pulpaires par augmentation de l’expression de l’OPG et du ALP. Une étude plus récente (17) a conclu que l’amélioration de l’expression de p-ERK, d’OPG et d’ALP est susceptible d’être bénéfique pour la régénération parodontale. Plusieurs études ont évalué l’emploi de PRF comme matériel de régénération pour le traitement des défauts parodontaux. Dans leur étude de cas, Chang et Zhao (17) ont évalué les modifications cliniques et radiographiques des défauts intra osseux parodontaux traités à l’aide de PRF. Ces auteurs ont conclu que le PRF représente une modalité thérapeutique efficace, car son application a entraîné une réduction des poches et une augmentation de l’attachement clinique, de même qu’une augmentation de la densité radiographique post op dans les défauts traités. Sharma et Pradeep (19) rapportent une plus grande réduction de la profondeur de sondage, une plus grande augmentation du niveau d’attachement parodontal, et un plus grand remplissage des défauts intraosseux impliquant les 3 parois après traitement par PRF et débridement avec lambeau ouvert comparé aux cas traités avec de l’OFD seul. Dans une autre étude (20) sur le traitement des atteintes de furcation mandibulaire de grade II, ces mêmes auteurs ont démontré une amélioration statistiquement significative pour des sites traités avec des PRF et de l’OFD comparé aux sites traités avec de l’OFD seul. Cependant, dans l’étude de Pradeep et al. (21), qui ont étudié l’efficacité clinique et radiologique des PRF et des PRP autologues pour le traitement des défauts intra osseux chez des patients atteints de maladie parodontale chronique, il n’y avait aucune différence significative entre les deux concentrés de plaquettes.
Techniques de chirurgie plastique parodontale
Très peu d’informations existent dans la littérature. Aroca et al. (22) ont comparé les résultats obtenus chez 20 patients traités avec un lambeau à repositionnement coronaire avec et sans membranes PRF. Après 6 mois, le groupe test a présenté une augmentation de la zone de tissu kératinisé mais le taux de recouvrement radiculaire complet était plus bas. Aleksic et al. (23) et Jankovic et al. (24) ont comparé le tissu conjonctif au PRF comme matériel de greffe pour le traitement de 19 patients avec des atteintes Classe I et Classe II de Miller. Après 6 mois, aucune différence significative n’a été trouvée entre les deux groupes en ce qui concerne le degré de recouvrement radiculaire ou l’augmentation de la zone de tissu kératinisé. Cependant, la technique a été jugée plus facile à tolérer et a été associée à moins de complications post opératoires dans le groupe traité par PRF, car il n’y avait pas de site donneur intraorale ; ces différences étaient statistiquement significatives. Tunali et Ozdemir (25) ont effectué une étude prospective « split mouth » afin de comparer le PRF et les greffes de tissu conjonctif chez 20 patients sur une période de 20 mois. Les deux méthodes de traitement ont réduit de manière significative le pourcentage de récession (respectivement 76% et 77%) et ont augmenté les niveaux d’attachement clinique (respectivement 2.90 mm et 3.04 mm).
Mécanisme d’action
Le plus grand problème rencontré dans notre analyse de la littérature concerne la comparaison de PRF / A-PRF avec une greffe de tissu conjonctif. Bien que ces deux matériaux aient des caractéristiques physiques similaires, leurs modes d’action et les produits finis obtenus diffèrent. Une greffe de tissu conjonctif prélevé au palais va transférer son expression génétique (kératinisation) du site donneur au site receveur. Karring et al. (20) ont décrit ce concept à l’aide d’un modèle animal. Le site receveur ne contribue en rien à la qualité ou à la quantité du tissu obtenu. Nous appelons ce mécanisme d’action la « fibrogenèse ». Le modèle A-PRF fonctionne d’une autre manière. Il faut considérer la fibrine comme une matrice biologique ; grâce à une source plus riche en VEGF et facteurs de croissance, l’A-PRF favorise et induit la formation d’un nouveau tissu à partir du site receveur. La qualité des tissus mous du site receveur est donc critique pour le succès de la
technique. S’il existe déjà une bande de tissu kératinisé, nous allons promouvoir la fabrication d’encore plus de tissu kératinisé. Si, au contraire, il n’y a qu’un tissu muqueux non attaché lâche, nous allons favoriser la formation du même type de tissu de mauvaise qualité. Nous appelons ce mécanisme d’action la « fibropromotion ». Pour que la fibropromotion puisse se produire, il faut satisfaire deux conditions : la biotenségrité et le volume. Ces facteurs s’appliquent aux procédures d’augmentation faisant appel à un quelconque modificateur biologique. L’incapacité de satisfaire ces deux paramètres aura pour conséquence l’échec de l’A-PRF et donc une déception clinique.
Biotenségrité
Ingber (27), de la Faculté de Médecine de Harvard, a démontré que les forces positives et négatives (tension et pression) générées à la surface cellulaire sont transférées via le complexe des filaments d’actomyosine à travers le cytosquelette jusqu’au noyau. Il existe donc un équilibre entre les forces extracellulaires et le compartiment intracellulaire tant que les forces appliquées sont dans les limites de tolérance de chaque groupe de cellules, donc organes.
La biotenségrité aide à guider la transmission des forces et à orchestrer la réponse multimoléculaire aux stress de tout calibre dans tous les systèmes d’organes. Lorsque les forces mécaniques externes appliquées sur la surface de la cellule (mécano-récepteurs de surface cellulaire) dépassent les limites de tolérance intracellulaire, une altération de la structure du cytosquelette intracellulaire entraîne des modifications de la biochimie intracellulaire et de l’expression génique, qui sont donc différentes de l’expression programmée d’origine. L’une des applications cliniques translationnelles de ce concept est l’impact de la tension du lambeau et la néo angiogenèse.
A l’aide d’un modèle animal, Mammoto et al. (28) ont démontré que l’étirement de la muqueuse chez la souris réduit la quantité de VEGF produite et entraîne donc une réduction de la vascularisation du lambeau. Pini Prato et al. (29) ont confirmé cette hypothèse dans une étude clinique randomisée contrôlée conçue pour mesurer la tension d’un lambeau de repositionnement coronaire avant la suture et pour comparer la réduction de la récession après un traitement par repositionnement coronaire du lambeau avec et sans tension. L’analyse statistique a mis en évidence le fait qu’une tension de lambeau minime (0.0 g à 0.4 g) favorisait une réduction de la récession tandis qu’une tension de lambeau plus élevée (4 g à 7 g) était associée avec une réduction de la récession moindre. Cet effet négatif de la tension du lambeau s’observe dans les reconstructions osseuses maxillo-faciales. Marx et al. (30) ont attribué le succès de leur technique d’augmentation verticale de l’os à un lambeau passif « nontensile » (sans traction) qui maintenait l’intégrité cellulaire du greffon osseux.
Volume
La quantification de toute fibropromotion cliniquement pertinenteà l’aide d’A-PRF nécessite la récolte d’une quantité suffisante de plaquettes afin qu’un certain nombre de facteurs de croissance soit libéré. Ces facteurs de croissance (voir ci-dessus) présents dans le treillis de fibrine serré et bien organisé seront libérés « goutte à goutte » à un rythme constantet stable au cours des 12 à 15 jours suivants (vitesse de résorption des membranes d’A-PRF). C’est pour cette raison que la qualité et la quantité de tissu mous obtenus après la chirurgie est en rapport direct avec la quantitéde matrice de fibrine greffée.
Dans leur analyse histomorphométrique quantitative de la pénétration cellulaire, Gahnaati et al. (7) ont évalué la composition des membranes d’A-PRF. Soixante-huit pourcent des membranes d’A-PRF étaient colonisés par les facteurs de croissance plaquettaires récoltés avec les échantillons. Ces observations, corrélées avec l’expérience clinique des auteurs, les ont amenés à conclure qu’il faut 3 ou 4 membranes par couple de dents pour obtenir une fibropromotion cliniquement visible (Fig. 2-4).
Traduction clinique
La technique chirurgicale que nous proposons est une simplification de la technique d’accès sous périostée par incision vestibulaire (31) et une amélioration de la technique de tunnelisation (32).
Incision
L’incision muqueuse verticale permet l’instrumentation horizontale (mésio-distale) et apico-coronaire d’un lambeau de pleine épaisseur, ce qui entraîne le relâchement total et le déplacement coronaire passif du complexe muco-gingival papillaire (Fig. 5, 6).




Préparation radiculaire et décontamination
Ce qui suit correspond aux mêmes indications déjà proposées pour les procédures parodontales muco-gingivales. Une préparation radiculaire soigneuse va créer une surface plane ou en négatif, permettant la mise en place d’un plus grand volume d’A-PRF, et une tension du lambeau moindre, et donc, in fine, une résorption membrane-A-PRF (biotenségrité) minime. La décontamination radiculaire à l’aide d’acide éthylène diamine tétra acétique (EDTA) 17% (double application pendant 2,5 minutes) enlèvera la boue dentinaire créée par le surfaçage/préparation radiculaire et permettra l’exposition des fibres de collagène tubulaires, améliorant ainsi la qualité du type d’attachement attendu.

Volume packing
Pour être significatif cliniquement, le clinicien doit utiliser un minimum de 3 ou 4 membranes par couple de dents. Le concept de remplissage par l’arrière (backpacking) de distal en mésial, fournira un volume de membranes d’A-PRF de densité homogène (Fig. 7). Grâce au relâchement du lambeau et le remplissage dense de distal en mésial, le lambeau va se positionner coronairement de manière physiologique, sans tension ni traction. Ce concept sans tension est au centre de l’application clinique de la tenségrité.

Les sutures
Des points de matelassier périostés apicaux sont la clé de la technique de suture et ont plusieurs objectifs : éviter toute tension marginale des sutures sur les membranes d’A-PRF, stabiliser et maintenir les membranes sur les surfaces radiculaires, et prévenir tout déplacement des membranes dans la zone muqueuse (Fig.8).
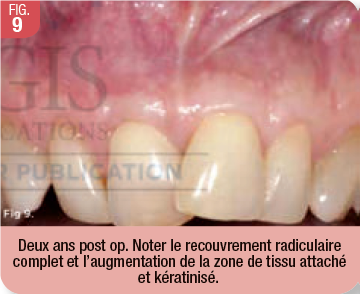
La reproductibilité clinique du procédé de recouvrement radiculaire associé à une augmentation de la zone de tissu kératinisé dépend de plusieurs facteurs (Fig. 9-11). L’un de ces facteurs, c’est une bonne compréhension du mécanisme d’action de l’A-PRF et son principe biologique. De plus, il faut exécuter avec précision la technique chirurgicale qui nécessite le relâchement du lambeau, un accès facile pour la mise en place des membranes sur les racines (volume), le déplacement physiologique du lambeau (biotenségrité), et une fermeture passive sans tension
ou sutures.
Conclusion
Le concept de la promotion des tissus mous assisté par la fibrine pour le recouvrement radiculaire à l’aide d’A-PRF représente une avancée dansles techniques muco-gingivales ; les principes fondamentaux d’un tel concept résident dans la compréhension des principes avérés de cicatrisation des plaies en médecine et l’application clinique de ces principes. Ce modèle innovant nécessite d’autres études cliniques et histologiques pour valider son intégration à long terme, car le recul actuel n’est que de deux ans.
Article traduit de l’anglais : A novel technique in root-coverage procedures: the Fibrin-Assisted Soft-Tissue Promotion Concept, Alexandre-Amir Aalam, Alina Krivitky Aalam, Joseph Choukroun, Compendium, April 2017, vol. 38 (4) : 220-226
Retour au Dossier Carte Blanche à Renaud Petitbois - AO News #26 / Juin 2019