Aménagements des tissus mous péri-implantaires
Dossier spécial : Les innovations en parodontologie ; aménageons la gencive - AONews #29 (Oct.2019)

Introduction
Les maladies péri-implantaires sont de plus en plus fréquemment rencontrées en raison de l’augmentation du nombre d’implants posés. La nouvelle classification de Chicago 2017 a introduit la notion de santé péri-implantaire et a également actualisé les définitions des deux grandes pathologies retrouvées autour des implants : la mucosite et la péri-implantite (1).

La santé péri-implantaire est cliniquement caractérisée par l’absence d’érythème, de saignement au sondage, d’œdème et de suppuration (2). La mucosite est une inflammation de la muqueuse péri-implantaire avec saignement et/ou suppuration au sondage et en l’absence de perte osseuse marginale continue. Le principal facteur étiologique retenu est l’accumulation du biofilm bactérien autour de l’implant (3). Enfin, la péri-implantite est un état pathologique apparaissant autour des tissus péri-implantaires, caractérisée par une inflammation de la muqueuse péri-implantaire avec saignement et/ou suppuration au sondage, l’augmentation de profondeur de poche (Fig. 1a) et une perte progressive de l’os sous-jacent (Fig. 1b) (4). D’après la littérature, plus de 3 patients sur 5 porteurs d’implant(s) présentent une mucosite péri-implantaire, et 1 patient sur 5 une péri-implantite (5). Perussolo et al. ont récemment établi une corrélation entre un défaut de tissu kératinisé et l’augmentation du risque de développer des maladies péri-implantaires (6).
Spécificités des tissus péri-implantaires

La muqueuse péri-implantaire présente de grandes similitudes anatomiques et biologiques avec les tissus parodontaux. Cependant, des différences majeures existent, lui conférant un comportement différent face à l’agression bactérienne. D’un point de vue histologique, l’absence de cément autour des implants conduit à une orientation parallèle des fibres conjonctives, et non perpendiculaire comme c’est le cas autour des dents (Fig. 2) (7). De plus, le tissu conjonctif péri-implantaire contient moins de fibroblastes et de structures vasculaires, mais plus de fibres de collagène, ce qui le rend comparable à un tissu cicatriciel. L’absence de desmodonte ne permet aucune absorption des contraintes mécaniques et induit une diminution de la vascularisation donc de l’apport en cellules immunitaires et indifférenciées réparatrices. Le turn over cellulaire en est moindre et la cicatrisation des tissus plus faible et plus lente.
Ainsi, cette faiblesse anatomique rend les tissus péri-implantaires plus perméables au passage des bactéries et à la diffusion de l’inflammation jusqu’au niveau osseux.

Implant et tissu kératinisé
Depuis l’apparition des implants, la relation entre tissu kératinisé et maladies péri-implantaires reste controversée en raison de l’absence de consensus. De nombreuses études montrent une corrélation entre l’absence de tissu kératinisé et la péri-implantite (8,9,10). Selon Sarmiento et al., le niveaux osseux péri-implantaire est influencé par des conditions pathologiques (inflammation d’origine infectieuse) et non-pathologiques (perte osseuse admise après la mise en place du pilier). Jusqu’à présent, les classifications des maladies péri-implantaires se limitaient à décrire la progression de la maladie et les conséquences qu’elle pouvait engendrer sur les tissus avoisinants. Il n’existait pas de classification basée sur les facteurs étiologiques des maladies péri-implantaires, pourtant, une meilleure compréhension des étiologies de la maladie permettrait de développer une prise en charge plus adaptée à la situation clinique. Sarmiento et al. ont donc voulu identifier et établir une classification étiologique des péri-implantites (Tableau 1). Ainsi, sur les 270 implants dentaires présentant une péri-implantite, la cause bactérienne reste l’étiologie principale dans 78,8% des cas et dans 5 % des cas, un défaut de tissu kératinisé en est la cause.
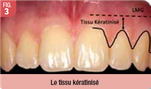
Le tissu kératinisé se définit en hauteur et en épaisseur. En hauteur, il s’étend depuis le sommet gingival jusqu’à la ligne muco-gingivale et comprend la gencive attachée et la gencive libre (Fig. 3). En épaisseur, il est composé d’un épithélium pavimenteux stratifié kératinisé, d’un tissu conjonctif sous-jacent et du périoste.

Influence de la hauteur de tissu kératinisé
Certaines études récentes montrent une corrélation entre l’absence de tissu kératinisé et l’augmentation du risque de développer des maladies péri-implantaires (11,12,13) . Elles ont évalué l’influence de la hauteur de tissu kératinisé sur la santé péri-implantaire en comparant différents paramètres cliniques entre un groupe avec tissu kératinisé et un sans tissu kératinisé (Fig. 4).
Les résultats obtenus montrent une amélioration significative de l’indice de plaque, de l’indice gingival, de l’indice de saignement et des récessions muqueuses en présence de tissu kératinisé. De plus, les études semblent suggérer que la présence d’une bande de tissu kératinisé autour des implants favoriserait un meilleur confort au brossage, en facilitant les manœuvres d’hygiène pour le patient ce qui limiterait l’infiltration bactérienne. Ainsi, une hauteur de 2 mm de tissu kératinisé est recommandée pour favoriser une meilleure santé péri-implantaire (14,15).
Influence de l’épaisseur de tissu kératinisé
Une autre notion est évoquée et semble au moins aussi importante que la hauteur malgré le faible nombre d’études sur le sujet : l’épaisseur de tissu kératinisé. Le dernier consensus américain de 2018 considère qu’un biotype est fin lorsque l’épaisseur de tissu kératinisé est inférieure à 2 mm, et qu’il est épais lorsque cette valeur est supérieure ou égale à 2 mm.
D’après l’étude de Linkevicius et al. (16) en 2015, la perte osseuse est plus importante chez le groupe de patients présentant un biotype fin comparé au groupe de patients présentant un biotype épais. De plus, un troisième groupe de patients présentant un biotype initialement « fin » a été suivi, et un épaississement a été réalisé lors de la pose implantaire. Les résultats ne montrent aucune différence significative comparés au groupe « biotype épais », et suggèrent donc qu’un biotype fin épaissi par une greffe revient à obtenir un biotype épais. Des résultats similaires sont retrouvés dans des études utilisant d’autres systèmes implantaires (17,18)

D’autre part, certains auteurs soulignent le rôle d’un tissu kératinisé épais dans la prévention de récessions péri-implantaires. Yoshino et al. (19) comparent le niveau gingival vestibulaire autour d’implants chez des patients ayant bénéficié une greffe de conjonctif enfoui ou non. Ses résultats montrent que le niveau gingival est significativement réduit dans le groupe non greffé comparé au groupe greffé.
En conclusion, la présence d’une hauteur et d’une épaisseur de 2 mm de tissu kératinisé autour des implants favorisent un meilleur contrôle de plaque avec moins d’inflammation, moins de saignement et diminue le risque de récessions muqueuses. En présence de plaque, un défaut de tissu kératinisé semble être un facteur de risque de développer une péri-implantite, ou de majorer la perte osseuse chez les patients déjà atteints (20). La perte osseuse est également reliée à l’épaisseur des tissus mous : le consensus américain et européen de 2018 admet qu’un biotype fin (< 2 mm) est plus à risque d’entrainer une perte osseuse marginale comparé à un biotype épais (≥ 2 mm) (21). Il convient donc de dépister ces zones à risques et de modifier le biotype par des procédures de chirurgie plastique péri-implantaire.

Les aménagements muqueux
Les principales interventions chirurgicales ont pour but d’apporter du tissu kératinisé en hauteur et en épaisseur, ou d’épaissir les tissus déjà présents.
Il existe 4 grandes familles de protocoles : l’operculisation, le lambeau déplacé apicalement, la greffe épithélio-conjonctive et la greffe de conjonctif enfoui.
Lorsque les conditions sont idéales, c’est-à-dire, avec un tissu kératinisé en hauteur et en épaisseur suffisantes (≥ 2 mm), l’operculisation sera réalisée afin de découvrir la tête de l’implant pour y connecter l’accastillage prothétique.
Lorsque ces conditions ne sont pas respectées, les 3 autres protocoles vont permettre l’aménagement de ces tissus. Ils peuvent se faire à différents moments du traitement implantaire : lors de la pose des implants (stade per-implantaire), lors du désenfouissement des implants (2ème temps chirurgical), ou à plus long terme après la pose des prothèses.
Dans les traitements en 2 temps chirurgicaux, le deuxième temps chirurgical est le moment privilégié pour intervenir.
Le tableau ci-dessus récapitule les différentes techniques chirurgicales d’aménagement des tissus mous péri-implantaires en fonction des conditions locales et du moment d’intervention.

Operculisation
Elle est réalisée lorsqu’on dispose d’une quantité suffisante de tissu kératinisé en hauteur et en épaisseur (≥ 2 mm) (Fig. 6a). Elle permet d’atteindre la vis de couverture sans nuire aux structures voisines tout en réduisant la surface d’os exposé. En effet, seule la portion gingivale située au-dessus de la vis est retirée, réduisant le traumatisme post-chirurgical (Fig. 6b). L’éviction gingivale est réalisée au moyen d’un bistouri à lame froide ou rotatif, ou encore au laser.
Greffe de conjonctif enfoui
La greffe de conjonctif enfoui est réalisée lorsque le tissu kératinisé est présent sur la crête avec une hauteur ≥ 2 mm, mais en trop faible épaisseur (< 2 mm) (Fig. 8a, 8b et 9a). Son intérêt est d’augmenter l’épaisseur des tissus, pour faciliter les mesures d’hygiène orale et améliorer le résultat esthétique.
Elle consiste à prélever une portion de tissu conjonctif provenant d’un site donneur, pour l’enfouir au niveau du site receveur (Fig. 8c, 8d et 9b).



Le prélèvement du greffon se fait principalement par deux techniques : celle de la single incision, développée par Zuhr et Hurzeler, ou celle du greffon épithélio-conjonctif désépithélialisé, développée par Zucchelli.
Pour le prélèvement épithélio-conjonctif désépithélialisé, deux incisions horizontales et deux incisions verticales sont réalisées afin de délimiter un rectangle.
La portion de tissu est ensuite disséquée en épaisseur partielle et désépithélialisée en dehors de la bouche (Fig. 7a).
Pour la single incision, la première incision est perpendiculaire au grand axe des dents maxillaires, au contact osseux, et située à 2 mm du rebord marginal. La longueur de l’incision correspond à la longueur du greffon nécessaire. A partir de ce trait d’incision, la lame de bistouri est orientée parallèlement à la surface épithéliale pour séparer la partie conjonctive de la partie épithéliale. Un troisième passage est effectué, plus en profondeur, parallèle à la seconde incision, pour détacher le greffon du plan profond (Fig. 7b). Cette dernière technique offre une cicatrisation de première intention et donne ainsi de meilleures suites post-opératoires pour le patient. Elle sera privilégiée dans les cas où la fibromuqueuse palatine est suffisamment épaisse. Dans le cas contraire, la technique du prélèvement épithélio-conjonctif désépithélialisé sera réalisée, compromettant le confort post-opératoire par une cicatrisation de seconde intention. Cette technique offre l’avantage de pouvoir être réalisée quel que soit le biotype tissulaire palatin.
Le greffon ainsi obtenu peut être enfoui au niveau d’un lit receveur préparé en épaisseur totale (au premier temps chirurgical), ou en épaisseur partielle (au deuxième temps chirurgical et après la pose des prothèses). La dissection en épaisseur partielle est préférable en raison de la source de vascularisation supplémentaire depuis le périoste.

La technique du rouleau
La technique du rouleau est une variante de la greffe de conjonctif enfoui ne nécessitant qu’un seul site opératoire. Elle consiste à disséquer un greffon de conjonctif pédiculé palatin puis à le rouler et l’enfouir sous un lambeau vestibulaire. Cette procédure permet de dégager la tête de l’implant et d’épaissir le tissu vestibulaire (Fig. 10). D’après Tunkel et al, cette technique offre de meilleurs résultats en termes de gain d’épaisseur comparée à un lambeau déplacé apicalement seul, mais ce dernier associé à un conjonctif enfoui reste la procédure de choix avec les valeurs les plus élevées de gain d’épaisseur (22).

Lambeau déplacé apicalement
Le lambeau déplacé apicalement est réalisé au second temps chirurgical, lorsque le tissu kératinisé est présent sur la crête (Fig. 11b), en hauteur et en épaisseur ≥ 2 mm, mais absent ou insuffisant (< 2 mm) en vestibulaire des implants (Fig. 11a). Le but est de déplacer le tissu en vestibulaire pour augmenter la hauteur de tissu kératinisé et conserver l’aspect esthétique. Elle consiste en une incision crestale déportée en lingual, associée à deux incisions de décharge verticales. Ces incisions de décharge s’étendent au-delà de la ligne muco-gingivale pour permettre le déplacement du lambeau. Ce dernier est disséqué en épaisseur partielle, apicalisé, puis suturé autour des piliers de cicatrisation. Une portion de tissu conjonctif reste exposée coronairement et cicatrisera en seconde intention en s’épithélialisant en surface (Fig. 11c). En cas de morphotype fin, un greffon de tissu conjonctif peut être associé à ce protocole. Ce dernier sera suturé au périoste et recouvert par le lambeau déplacé apicalement.

Greffe épithélio-conjonctive
La greffe épithélio-conjonctive est indiquée en cas d’absence de tissu kératinisé associée à des conditions locales défavorables (présence de plaque, insertion freinale haute…) (Fig. 12a et 13a). C’est la technique de choix pour augmenter le tissu kératinisé en hauteur et en épaisseur, et renforcer ces zones de moindre résistance. Elle est réalisée au second temps chirurgical ou après la pose des prothèses.
La préparation du lit receveur se fait au moyen d’une première incision horizontale, coronairement à la ligne muco-gingivale, associée à deux incisions de décharge verticales, délimitant un trapèze à grande base apicale s’étendant au-delà de la ligne muco-gingivale.

La berge labiale est suturée au périoste afin de disposer d’une surface périostée adhérente non mobilisable par traction de la lèvre ou de la joue (Fig. 12b)
Le greffon épithélio-conjonctif est ensuite positionné et réajusté face conjonctive contre le lit receveur. Il est d’abord suturé par des points en O à ses extrémités pour le maintenir dans la position souhaitée. Puis il est plaqué par des points matelassiers horizontaux et verticaux (Fig. 12c et 13b).
C’est une technique fiable, simple d’exécution, et capable d’apporter une grande quantité de tissus (Fig. 12d à 12g et 13c), mais elle présente certains inconvénients dont un aspect inesthétique et des suites post-opératoires douloureuses liées à la cicatrisation de seconde intention au niveau du site donneur. (Voir article sur la greffe épithélio-conjonctive).
Conclusion
En l’absence de consensus, le choix du protocole est à adapter au patient et à la situation clinique. Aménager les tissus mous péri-implantaires constituerait un moyen de prévention des maladies péri-implantaires. De plus, la présence de tissu kératinisé facilite la ré-intervention sur les sites atteints de maladies péri-implantaires, lors du repositionnement des tissus mous au cours des thérapeutiques additives et résectrices.
Enfin, une maintenance péri-implantaire stricte et régulière reste essentielle pour la réussite du traitement implantaire.
Bibliographie
1. Berglundh, T., G. Armitage, M. G. Araujo, G. Avila-Ortiz, J. Blanco, P. M. Camargo, S. Chen, et al. « Peri-implant diseases and conditions. Consensus report of workgroup 4 of the 2017 world workshop on the classification of periodontal and peri-implant diseases and conditions. » Journal of Periodontology 89 Suppl 1 (2018): S313‑18
2. Araujo, M. G., et J. Lindhe. « Peri-implant health ». Journal of clinical periodontology 45, no Suppl. 20 (2018): S230‑36.
3. Heitz-Mayfield, L. J. A., et G. E. Salvi. « Peri-implant mucositis ». Journal of clinical periodontology 45, no Suppl. 20 (2018): S237‑45.
4. Schwarz, F., J. Derks, A. Monje, et H. - L. Wang. « Peri-implantitis ». Journal of clinical periodontology 45, no Suppl. 20 (2018): S246‑66.
5. Salvi, G. E., R. Cosgarea, et A. Sculean. « Prevalence and mechanisms of peri-implant diseases ». Journal of dental research 96, no 1 (2017): 31‑37.
6. Perussolo, J., A. B. Souza, F. Matarazzo, R. P. Oliveira, et M. G. Araújo. « Influence of the keratinized mucosa on the stability of peri-implant tissues and brushing discomfort. A 4-year follow-up study ». Clinical Oral Implants Research 29, no 12 (2018): 1177‑85.
7. Berglundh, T., J. Lindhe, I. Ericsson, C. P. Marinello, B. Liljenberg, et P. Thomsen. « The soft tissue barrier at implants and teeth ». Clinical oral implants research 2, no 2 (1991): 81‑90.
8. Sarmiento, H. L., M. R. Norton, et J. P. Fiorellini. « A classification system for peri-implant diseases and conditions ». The international journal of periodontics & restorative dentistry 36, no 5 (2016): 699‑705.
9. Souza, A; B., M. Tormena, F. Matarazzo, et M. G. Araújo. « The influence of peri-implant keratinized mucosa on brushing discomfort and peri-implant tissue health ». Clinical oral implants research 27, no 6 (2016): 650‑55.
10. Ladwein, C., R. Schmelzeisen, K. Nelson, T. V. Fluegge, et T. Fretwurst. « Is the presence of keratinized mucosa associated with periimplant tissue health ? A clinical cross-sectional analysis ». International journal of implant dentistry 1, no 1 (2015): 11.
11. Bassetti, R. G., A. Stähli, M. A. Bassetti, et A. Sculean. « Soft tissue augmentation around osseointegrated and uncovered dental implants : a systematic review ». Clinical oral investigations 21, no 1 (2017): 53‑70.
12. Thoma, D. S., N. Naenni, E. Figuero, C. H. F. Hämmerle, F. Schwarz, R. E. Jung, et Ignacio Sanz-Sánchez. « Effects of soft tissue augmentation procedures on peri-implant health or disease : a systematic review and meta-analysis ». Clinical oral implants research 29, no Suppl. 15 (2018): 32‑49.
13. Linkevicius, T., A. Puisys, L. Linkeviciene, V. Peciuliene, et M. Schlee. « Crestal bone stability around implants with horizontally matching connection after soft tissue thickening : a prospective clinical trial ». Clinical implant dentistry and related research 17, no 3 (2015): 497‑508.
14. Puisys, A., et T. Linkevicius. « The influence of mucosal tissue thickening on crestal bone stability around bone-level implants. A prospective controlled clinical trial ». Clinical Oral Implants Research 26, no 2 (février 2015): 123‑29.
15. Linkevicius, T., A. Puisys, M. Steigmann, E. Vindasiute, et L. Linkeviciene. « Influence of vertical soft tissue thickness on crestal bone changes around implants with platform switching : a comparative clinical study ». Clinical Implant Dentistry and Related Research 17, no 6 (2015): 1228‑36.
16. Yoshino, S., J. Y. K. Kan, K. Rungcharassaeng, P. Roe, et J. L. Lozada. « Effects of connective tissue grafting on the facial gingival level following single immediate implant placement and provisionalization in the esthetic zone : a 1-year randomized controlled prospective study ». The international journal of oral & maxillofacial implants 29, no 2 (2014): 432‑40.
17. Canullo, L., D. Peñarrocha-Oltra, U. Covani, D. Botticelli, G. Serino, et M. Penarrocha. « Clinical and microbiological findings in patients with peri-implantitis : a cross-sectional study ». Clinical oral implants research 27, no 3 (2016): 376‑82.
18. Hämmerle, C. H. F., et D. Tarnow. « The etiology of hard- and soft-tissue deficiencies at dental implants. A narrative review. » Journal of Periodontology 89 Suppl 1 (2018): S291‑303.
19. Tunkel, J., L. de Stavola, et F. Khoury. « Changes in soft tissue dimensions following three different techniques of stage-two surgery : a case series report ». The International
