Approches des interactions tissulaires complexes au cours des processus de réparation et de régénération osseuse en implantologie
Dossier spécial Voyage en terre méconnue - AO #17 - Avril 2018

Patrick PHILIP (Nice)
Izahk BINDERMAN (Tel Aviv)
Gérad SCORTECCI (Nice)
Le tissu osseux représente au sein du corps humain un complexe multi cellulaires semi rigide doté de propriétés élastiques. Ce complexe multicellulaire qui renferme les cellules souches et le tissu hématopoïétique est en résonance constante avec ce monde interne qu’il protège et l’environnement externe dans lequel l’homme devra évoluer pour survivre. L’os apparait comme une structure tissulaire que la nature a créée dans le but de pouvoir transmettre des contraintes en tension/compression, en cisaillement et en torsion sur de longues distances. De telles contraintes sont nécessaires dès que le squelette est soumis à la gravité ou que l’individu fournit une activité musculaire. Tous les tissus osseux des os de la tête et du corps sont associés et mobilisés par les muscles. Les os de toutes les composantes du tissu osseux vont donc subir en permanence des variations de tensions liées à l’exercice et à la gravité transformant ainsi tout os en un capteur de contrainte qui devra répondre et s’adapter en permanence au cours du temps à ces variations de tensions.
Julius Wolff à la fin des années 1800 (Wolff J.D. 1892) stipule un principe à savoir que la forme externe d’un os s’adapte en fonction des contraintes auxquelles l’os est soumis. La deuxième contribution de Julius Wolff concerne l’optimisation de l’architecture interne des os, c’est-à-dire des trajectoires trabéculaires à l’intérieur des cavités médullaires (Frost HM 1994). Les trabécules ne sont pas orientées au hasard mais suivent un arrangement qui est lui-aussi gouverné par les sollicitations externes. Ainsi, un os long diminue sa courbure et se redresse afin de mieux répondre à des contraintes appliquées le long de son axe principal.
La forme de chaque os représente la mémoire de forme donc de structure d’une espèce. La forme et la structure de l’os seront associées à une fonction dans le cadre d’une contrainte de forme liée à sa fonction et à la gravité. La forme et donc sa structure sont génétiquement définiés et reproduitesau cours du temps (mémoire de l’espèce) grâce aux cellules souches (mémoire de la vie) et aux contraintes biomécaniques qu’elles subissent en permanence de par l’exercice et la gravité (Vico et al.,. 2000).
Le tissu vasculaire permet à tous les tissus de communiquer entre eux et donc d’être tous thermorégulés. Si le tissu osseux structure l’être humain, le tissu hématopoïétique qu’il renferme permet à tous les tissus de l’organisme de s’oxygéner, de se défendre et de maintenir l’intégrité du réseau vasculaire. Ces trois tissus dérivent tous de la même cellule souche mésenchymateuse produite au niveau du mésoderme primitif, l’un des trois feuillets embryonnaires dérivés de l’épiblaste après le processus de gastrulation. Cette cellule souche est commune, à titre de rappel, aux lignées cellulaires ostéo-cartilagineuses, musculaires striés, adipeuses, vasculaires, et hématopoïétiques ainsi qu’à toutes les cellules chargées de la production des Matrices Extra Cellulaire (MEC). Cette cellule souche va persister au cours de la vie adulte et va donc être impliquée dans tous les processus cellulaires de réparation et de régénération du tissu osseux. Cette cellule souche est observée principalement au niveau de deux structures histologiques de l’os, le périoste et l’endoste, mais peut être aussi localisée dans la circulation sanguine ainsi que dans de très nombreux autres tissus de l’organisme.
Les tissus osseux, hématopoïétique et vasculaire représentent donc bien des entités complexes multi tissulaires et interdépendantes. Ces complexes sont en permanence en résonnance au sein de l’entité du corps humain au travers des tensions musculaires révélatrices des relations et des tensions du monde externe et interne pour maintenir un équilibre et une harmonie interne définis sous le terme d’homéostasie.
Sur le plan embryonnaire, l’ossification endochondrale se développe à partir de ces cellules souches mésenchymateuses amenées par les vaisseaux qui ont pénétrés dans l’ébauche cartilagineuse pour produire l’os trabéculaire et l’os alvéolaire.
L’ossification endoconjonctive est quant à elle produite dans le périoste où se niche d’autres familles de cellules mésenchymateuses qui vont être à l’origine de la formation de l’os cortical primaire après la transformation du périchondre en périoste. Puis, dans un deuxième temps, cette structure corticale primaire multi lamellaire va progressivement être transformée par le remaniement osseux en os cortical haversien avec l’apparition des premiers ostéons.
Les premiers ostéoclastes nés de l’hématopoïèse qui s’est développé dans la moelle osseuse avec l’arrivée des vaisseaux et des cellules souches mésenchymateuses, vont pénétrer l’os cortical primaire. Un bourgeon vasculaire va suivre ces ostéoclastes qui creusent l’os cortical primaire pour pouvoir amener progressivement des cellules souches mésenchymateuses et des ostéoblastes dans le canal de Havers creusé par l’ostéoclaste. Ces cellules souches vont donc permettre simultanément in situ, l’accroissement du réseau vasculaire cortical et la production des précurseurs osseux, les ostéoblastes qui vont tapisser les faces internes du canal de havers puis le refermer par voie centripète pour former un ostéon. Le bourgeon vasculaire, au centre des « Bone Multicellular Units » (BMU) ordonne donc chronologiquement ces phénomènes de résorption et de formation osseuse à partir d’une cellule souche commune, la cellule souche mésenchymateuse. Un BMU peut prendre deux formes suivant sa localisation (Frost HM, 1969). Sur une surface, il va produire une érosion localisée connue sous le nom de « lacune de Howship ». À l’intérieur d’un trabécule ou dans l’os cortical, le BMU va s’activer en formant un « cône de coupe », c’est-à-dire fonctionner comme un tunnelier en érodant le minéral ancien sur une surface approximativement circulaire et en redéposant de l’ostéoïde. En histologie, cette forme de réparation est connue sous le nom de « remaniement Haversien ». Le nombre de BMU actifs simultanément est estimé de 1 à 3 millions. Leur densité sur des coupes histologiques est de 1 à 2 par mm2. La durée de vie d’un BMU est de six à neuf mois, durée pendant laquelle il érode et redépose environ 0.05mm3 de tissu osseux (Frost HM, 1989).
Ces ostéoclastes vont ainsi permettre de développer la constitution d’un réseau de canaux, les canaux de Havers qui communiquent tous entre eux par les canaux de Volkman jusqu’au canal médullaire. Ces réseaux de canaux intra-osseux qui renferment les vaisseaux sanguins, vont ainsi permettre d’établir une continuité vasculaire entre le réseau vasculaire cortical péri-osseux et le réseau vasculaire intra-médullaire.
Ce réseau de canaux va permettre in fine :
- une vascularisation de tout le tissu osseux en communication avec la circulation générale
- de modifier les tensions du tissu de l’os cortical primaire et secondaire en le rendant plus souple et plus élastique
- la formation et la diffusion d’un liquide interstitiel à partir du réseau vasculaire des canaux de Havers et de Volkman, lequel va diffuser entre tous les ostéocytes et la matrice extra cellulaire de tout le tissu osseux péri canalaire, jusqu’à son retour au réseau veineux par d’autres canaux de Haversd’havers et de Volkman. Les ostéocytes ne sont pas isolés dans leurs lacunes mais sont interconnectés avec toutes les autres cellules du tissu osseux au sein d’un unique réseau partagé.
Toute déformation d’une pièce osseuse va donc engendrer une modification du déplacement de fluide à l’intérieur de la structure osseuse. Les cellules osseuses sont capables de détecter ces minimes variations de pressions sur la MEC et d’envoyer par méchano transduction des signaux aux cellules de surface de l’endoste afin d’augmenter le nombre d’ostéoblastes et donc, la déposition de nouvelles couches minérales.
Ce mécanisme montre bien que les ostéocytes ne sont pas isolés dans leur lacune mais fonctionnent comme un réseau cellulaire interconnecté par l’intermédiaire :
- des Gap jonctions
- des tensions de leur cytosquelette respectif. Toute modification tensionnelle d’une cellule retentit sur toutes les cellules du réseau de la structure osseuse. Un mode de transduction des informations de la structure aux cellules du tissu osseux, va être lié au déplacement des fluides du liquide interstitiel dans les espaces lacunaires et canaliculaires du réseau des ostéocytes, ainsi qu’aux variations de tension de la structure.
Par ailleurs, ces fluides sont fortement chargés électriquement. En se déplaçant, ils vont entraîner des ions et créer une différence de potentiel électrique locale. Ce phénomène est appelé « Streaming potentials ». Ces variations de potentiels peuvent avoir des actions sur la migration, la croissance et la différenciation des cellules souches (Sundelacruz et al.,. 2009 ; Sundelacruz et al.,. 2015 ; Levin et al.,. 2017 ; McLaughlin et al.,. 2018).
La circulation intra-osseuse présente une double particularité : l’os est une cavité close où la pression intra-osseuse doit être maintenue constante. C’est en partie pour cela que les structures vasculaires, notamment veineuses, sont particulièrement malléables
Cette circulation intra-osseuse va ainsi permettre avec le liquide interstitiel qui circule entre le réseau des ostéocytes, les fibres de collagène et les cristaux d’hydroxyapatite :
- des échanges de minéraux, de cytokines, facteurs de croissance, d’hormones et de composants ioniques entre le sang et le tissu osseux;
- le drainage des cellules sanguines et des cellules souches produites dans la moelle puis mobilisées dans le réseau vasculaire médullaire;
- la circulation de ces cellules souches qui sont intra-vasculaires, non seulement dans le tissu osseux mais aussi dans tous les tissus de l’organisme. Par ailleurs, tout trauma va engendrer une amplification de la mobilisation des cellules souches médullaires dans la circulation sanguine, à destination du tissu lésé, comme nous l’avons montré pour la première fois dans le cadre des accidents vasculaires cérébraux (Dunac et al., 2007).
Ainsi sur le plan vasculaire, l’ostéonécrose aseptique et l’infarctus osseux peuvent être les conséquences d’oblitérations vasculaires aiguës alors que l’ostéoporose peut être les conséquences de l’artériosclérose.
Une autre des particularités de la structure du tissu osseux est donc de pouvoir se résorber et se régénérer en permanence à partir de ces cellules souches mésenchymateuses pour maintenir ces complexes tissulaires fonctionnels en parfaite résonnance au travers d’un équilibre méchano biologique complexe (Wiskott HWA, 2011).
L’os cortical, qui s’est développé autour des vaisseaux contenus dans les canaux de Havers et de Volkman, est composé sur un plan structural de deux éléments : Le premier élément est constitué par la partie organique associant les cellules du tissu osseux et des fibres, principalement du collagène de type I, mais également des glycosaminoglycanes produits par des ostéocytes. Ces fibres sont toutes interconnectées pour former un réseau fibrillaire qui constitue la partie organique de ce tissu osseux (35%). Le deuxième élément est constitué par la partie minérale, associant les cristaux d’hydroxyapatite produits par les cellules osseuses et incrustés autour de ces fibres de collagène (65%). Ces cristaux d’hydroxyapatite ont la forme de plaques hexagonales de 40-50 nm de long et 2-5 nm d’épaisseur. Chaque cristal représente une unité fonctionnelle pour les échanges ioniques au travers de deux zones fonctionnelles : une zone profonde où les échanges ioniques sont lents et une zone superficielle avec une coque d’hydratation où les échanges sont très rapides avec le liquide interstitiel qui diffuse à partir et vers les vaisseaux sanguins, au travers de toutes les composantes de la fraction minérale et organique. Du fait de leur forme et de leur nombre, les cristaux d’hydroxyapatite offrent une surface considérable (de l’ordre de 10 à 200 m2 par gramme de tissu osseux). Toutes ces composantes, minérale et organique du tissu osseux, sont structurellement liées et inter-reliées entre elles par des récepteurs multiples et divers tels que l’ostéocalcine, l’ostéonectine, l’ostéospondine, la thrombospondine…Le liquide interstitiel en diffusant entre ces cristaux va déposer ou libérer les composants phosphocalciques permettant une régulation de la calcémie.
L’os apparait donc comme un composite organique dans lequel les fibres assurent la résistance en tension et les minéraux, la résistance en compression.
Le Dr Robert O. Becker, chirurgien orthopédiste, a mis en évidence qu'une compression sur un os produit un courant électromagnétique par piézoélectricité. Ainsi, une compression mécanique entraîne un courant électrique et inversement, un courant électrique sur cette structure entraîne une réaction mécanique.
In vivo, quel que soit l'espèce animale, une l'activité physiologique normale produit de 2 000 à 3 500 microdéformations, sachant qu’une microdéformation correspond à un allongement ou un rétrécissement relatif d’un millionième de la longueur totale du spécimen. Si ces microdéformations sont inférieures à 1 000 microdéformations, le tissu osseux tend à disparaître : la résorption l'emporte alors sur l'apposition.
Dans le monde dentaire, l’os est souvent perçu comme un tissu qui doit être « protégé » des contraintes par peur d’une surcharge et la crainte d’une résorption. En fait, c’est la démarche opposée qui s’applique car c’est la sous-stimulation de l’os qui provoque sa diminution de masse. Au contraire, si ces microdéformations sont supérieures à 4 000 microdéformations, il y a augmentation de la masse osseuse : l'apposition l'emporte alors sur la résorption. Nombre de publications ont attribué la perte d’intégration d’un implant dansde son lit osseux à une surcharge mécanique. Cependant cet effet n’a jamais pu être reproduit expérimentalement car il est virtuellement impossible de « désintégrer » un implant sous des charges masticatoires normales.
Le remodelage de l’os repose actuellement sur trois hypothèses non exclusives.
- La première hypothèse est qualifiée « d'élastique » : c'est l'activité mécanique normale, sans rupture du matériau de soutien qui permet la régulation du remodelage (Rubin CT, Lanyon LE, 1985 ; Smith EL et Gilligan C, 1996). Comme le dit Pr D. Ingberg (Université Harvard, USA) la restructuration mécanique de la cellule et du cytosquelette indique apparemment quoi faire à la cellule. Toute déformation du tissu osseux induit par méchano transduction, l’activation de gènes inducteurs de la synthèse de facteurs ostéogéniques.
- La seconde hypothèse est dite « d'endommagement », ce sont les défauts accumulés dans le tissu, tels que les micro cracks, qui sont responsables du mécanisme de remodelage (Frost HM, 1960). Seule une mort cellulaire programmée des ostéocytes permet la régulation de ce processus avec le relargage de facteurs ostéogéniques dans les fluides de l’os.
- La troisième hypothèse repose sur la théorie « de la poro-élasticité ». Dans cette hypothèse, le tissu osseux spongieux ou cortical contient une phase solide poreuse dont les porosités sont complètement remplies par un fluide. Ainsi, dans le cadre de sollicitations mécaniques transitoires in vivo, il est indispensable de considérer non seulement le comportement mécanique de la structure solide mais aussi les interactions biologiques et cellulaires présentes entre cette structure et les fluides qu'elle contient et qui la traverse.
Les mécanismes par lesquels l’os détecte les augmentations de contrainte et réagit par une augmentation de masse ne sont que partiellement élucidés. Compte tenu de l'étendue de son apparition dans le corps, le remodelage osseux est un processus complexe qui fonctionne en étroite coordination avec d'autres processus physiologiques aussi divers que le métabolisme énergétique, le cycle veille-sommeil et la reproduction. Les circuits neuronaux dans le cerveau jouent un rôle très important dans la coordination du remodelage osseux et remplissent cette fonction en synchronisation avec les signaux hormonaux environnementaux et périphériques (Quiros-Gonzalez I et Yadav VK, 2014).Quiros-Gonzalez I et Yadav VK, 2014). La structure du tissu osseux va ainsi résulter d’un développement et d’une homéostasie complexe co-intégrant ainsi simultanément :
- des lois de la physique (biomécanique de l’os) ;
- de la biophysique (effet piezo électrique de l’os) ;
- de la biochimie (les facteurs de croissance de la superfamille des TGF-β (BMP, IGF, FGF, PDGF, EGF etc…, les hormones et molécules apparentées (calcitonine, thyroxine, œstrogènes, parathormone, dexaméthasone, prostaglandines etc...), ainsi que d’autres activateurs (ostéonectine, acide rétinoïque, vitamine D, acide hyaluronique, phosphatase alcaline, ostéocalcine, ostéopontine etc...) ;
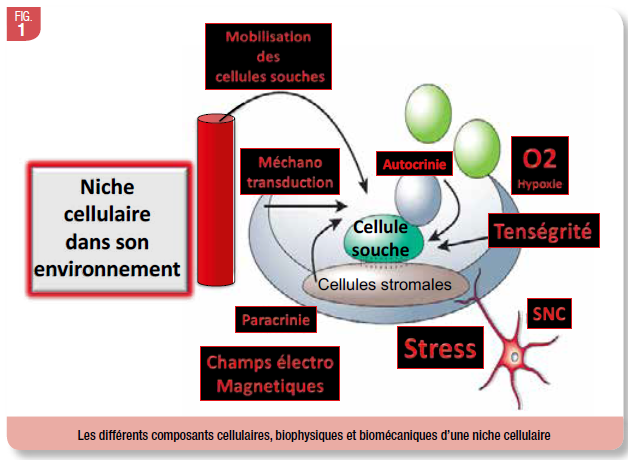
- de la biologie cellulaire (des cellules souches à l’ostéocytes, impliquant les cellules souches mésenchymateuses avec leurs microenvironnements (les cellules du stroma) et 5/ de la génétique (Figure 1) . ;
- de la génétique (Fig. 1).
Du fait des variations de tensions qu’il subit durant tout son développement, le tissu osseux va devoir développer des mécanismes biologiques spécifiques et complexes qui vont lui permettre de s’adapter en permanence aux variations des contraintes mécaniques externes qui lui sont imposées. L’objectif pour ce tissu osseux élastique, est de parvenir à conserver cet équilibre subtil qui maintienne avec son micro environnement la mémoire de forme de l’espèce au cours de la vie et sa structure au cours du temps.
Si les cellules souches sont localisées et protégées à l’intérieur du tissu osseux, certaines vont le quitter et circuler en permanence au travers du réseau vasculaire de l’os, mais aussi de tout l’organisme pour participer à la réparation et à la régénération de tous les tissus.
Les tissus osseux, hématopoïétique et vasculaire apparaissent donc comme une complexe tripartite indissociable, dérivée d’une cellule souche commune, la cellule souche mésenchymateuse qui va avec son microenvironnement
- - permettre durant toute l’histogénèse, l’ossification endochondrale et endoconjonctive ;
- permettre tout au long de la vie, la production des progéniteurs et des précurseurs osseux, vasculaire et hématopoïétique;
- permettre de réguler et de coordonner l’équilibre hiérarchique des populations cellulaires de chaque lignée des formes les plus immatures aux formes différentiés ;
- permettre de réguler et de coordonner l’équilibre cyto démographique et fonctionnel de ces 3 lignées cellulaires ;
- permettre de gérer et de contrôler le déroulement de la réponse inflammatoire jusqu’à la cicatrisation du tissu osseux.
Par définition, toute cellule souche a la capacité de s’auto-renouveler indéfiniment par division cellulaire et de se diviser de manière asymétrique donnant naissance à de nouvelles cellules souches et à des cellules progénitrices qui vont proliférer, tout en se différentiant jusqu’aux stades des précurseurs de lignées du tissus osseux, hématopoïétique et vasculaire. A ce stade, les cellules vont s’arrêtées de proliférer et vont se différencier en produisant les molécules fonctionnelles et spécifiques de la lignée cellulaire impliquée dans cette évolution. Les cellules souches ont donc pour mission d’assumer le renouvellement et l'homéostasie des tissus de l'organisme tout au long de l'existence.
Chaque cellule souche n’est jamais totalement isolée dans les tissus. Elle est toujours associée et connectée à des cellules du microenvironnement, les cellules stromales regroupées autour des cellules souches pour constituer des niches cellulaires. La niche est une structure anatomique et fonctionnelle qui assure la maintenance et la régulation des fonctions des cellules souches. Les cellules souches hématopoïétiques (CSH) ont leur propre niche spécifique, située au sein de la moelle osseuse chez l'adulte. Celle-ci doit assurer à la fois la maintenance des cellules souches et l'hématopoïèse, mais aussi réguler la mobilisation des cellules souches en dehors de la niche dans le sang circulant. et leur adressage à nouveau dans la niche. La situation et la composition de cette niche sont encore très mal connues.
Deux types de niches ont été décrites au sein de la moelle osseuse : les niches endostéales et les niches vasculaires. De nombreux arguments expérimentaux sont en faveur d'une localisation de CSH près de l'endoste, les cellules de la lignée ostéoblastique en étant le principal composant. L’ostéospondine apparait comme un élément capital dans cette niche endostale en attirant, retenant et régulant ainsi le devenir de ces CSH au sein de cette niche (Nilsson et al, 2005). Toutefois, d'autres résultats indiquent que des CSH pourraient se situer aussi en région péri vasculaire, à proximité immédiate des capillaires sinusoïdes de la moelle. Les cellules composant cette niche vasculaire, outre les cellules endothéliales, seraient composées d’un ensemble de cellules souches situées en amont des cellules souches mésenchymateuses et d’autres encore plus immatures situées autour et dans la paroi vasculaire.
Récemment, l'existence d'une troisième niche, de type mésenchymateuse péri-vasculaire, a été proposée comme étant le chaînon manquant entre les niches endostéales et vasculaires. Il est actuellement admis que les niches endostéales, principalement constituées par les ostéoblastes d'origine mésenchymateuses et les ostéoclastes d'origine hématopoïétique, participent au maintien des CSH en quiescence ainsi qu'à l'expression de leur fonctionnalité (Frenette et al.,. 2013, Yu et al.,. 2015).
Enfin, la participation du système neuro-sympathique, des cellules de Schwann ainsi que des lymphocytes Treg, a apporté une nouvelle dimension neuro-immune à la régulation par les niches médullaires. Au sein de telles niches, la régulation des CSH fait intervenir des interactions avec les différents types cellulaires (cellules stromales, cellules mésenchymateuses, cellules ostéo-compétentes, adipocytes, cellules endothéliales…), des facteurs diffusibles (cytokines, chimiokines...), des molécules de la MEC et des éléments environnementaux tels que la concentration en oxygène et en calcium (Haylock et al.,. 2005).
La question de la dualité de la niche hématopoïétique, ostéoblastique et vasculaire, ou de son unicité, n'est pas actuellement résolue. Toutefois, quel que soit le modèle, la niche semble résulter d'un duo entre cellules souches mésenchymateuses et hématopoïétiques.
La compréhension du fonctionnement des niches de cellules souches, qui peuvent être permanentes ou transitoires, est devenue un sujet majeur pour les sciences fondamentales et la médecine. Il est important de comprendre ces interactions multiples et complexes (Fig. 1) et trouver des réponses aux questions :
- comment les cellules de la niche et les signaux extracellulaires peuvent contrôler le destin des différentes cellules souches de l’organisme ;
- comment ces connaissances sont susceptibles d’influencer le développement de nouvelles thérapies en implantologie osseuse.
Impacts d’un trauma osseux sur les interactions tissulaires en implantologie
Tout trauma osseux produit lors de la pose d’un implant dentaire, va induire une désorganisation de ces structures osseuses donc de leur homéostasie.
Tout acte d’implantologie, va donc induire et produire au sein du tissu osseux du fait du trauma :
- une perturbation de la mécanique des fluides ;
- des variations de pressions intra vasculaires mais aussi extra vasculaires (vasodilatation) ;
- une modification des composants moléculaires et cellulaires.
Tout acte d’implantologie va enfin enclencher, du fait du trauma, une réponse inflammatoire qui va amplifier à des degrés variables ces perturbations biomécanique et fluidique :
- selon la nature et l’amplitude de l’acte chirurgical ;
- la nature de l’implant et des biomatériaux utilisés et
- la conduite des processus inflammatoires et leur maîtrise par le praticien.
Qu’est-ce qu’une réponse inflammatoire ?
La réponse inflammatoire est par définition la réponse de l’organisme à une agression de l’atteinte de l’intégrité tissulaire, et ce, quel que soit l’agent responsable de cette agression. L’atteinte de l’unité fonctionnelle du tissu osseux par l’activation ou la rupture d’une anse capillaire en est le facteur déclenchant. Cette atteinte initiale est suivie d’une cascade d’évènements qui se succèdent dans le temps au travers de 53 phases que le praticien se doit d’appréhender et de maitriser (Fig. 2) :
- la phase vasculaire impliquant les processus de coagulation chargée de stopper l’épanchement sanguin extravasculaire ;
- la phase cellulaire avec ses réponses inflammatoires, tout d’abord non spécifique, avec la migration des polynucléaires neutrophiles et de monocytes du sang dans le tissu, puis spécifique, avec l’activation des cellules immunitaires ;
- la phase de cicatrisation qui permettra de rétablir une continuité vasculaire fonctionnelle en impliquant les processus d’angiogénèse ;
- d’angiogenèse ;
- la phase de reconstruction de la matrice extracellulaire par les fibroblastes qui permet de rétablir une continuité architecturale du tissu osseux ;
- la phase de régénération des cellules du tissu osseux à partir des ostéoblastes produits à partir des cellules souches.
Toute réparation tissulaire après un traumatisme tissulaire ne pourra donc se faire sans l’implication et la coordination de chacune de ces phases de la réponse inflammatoire. Cette réponse inflammatoire qui est chargée de réparer l’intégrité et la fonctionnalité tissulaire répond à des séquences chrono biologiques bien précises. L’accompagnement de cette réponse inflammatoire par le chirurgien est primordial. Le praticien pourra aboutir selon son niveau de maîtrise :
- soit à la cicatrisation finale du tissu traumatisé, avec une ostéo intégration parfaite et persistante au cours du temps ;
- soit à un échec du processus d’ostéo intégration, du fait des conséquences de l’acte chirurgical sur le tissu osseux, de la nature de l’implant ou des matériaux utilisés lors de la mise en place de l’implant.
Toute atteinte de la structure et des composants du tissu osseux qui ne peut pas être gérée physiologiquement par les processus de réparation et de cicatrisation, dépendant de la réponse inflammatoire, conduira à une réponse inflammatoire chronique délétère avec une fibrose synonyme d’échec en implantologie.
Dans un organisme sain, le système immunitaire inné fournit la première ligne de défense contre les signaux de danger externes ou internes, en déclenchant une réponse inflammatoire protectrice qui se développe au cours du temps par différentes phases, de l'initiation, et de l'inflammation complète à la résolution et au rétablissement de l’intégrité des tissus. La première phase d'une réaction inflammatoire vise à détruire les agents pathogènes.
La seconde phase d’une réaction inflammatoire est la phase d'élimination des cellules mortes et mourantes, de la matrice extracellulaire endommagée et des débris cellulaires pour aboutir à une phase de récupération dans laquelle le tissu est réparé et entièrement fonctionnelle.
En fait, si la défense contre les menaces est une priorité pour éviter les dommages tissulaires, maintenir l'homéostasie (c'est-à-dire maintenir la morphologie tissulaire et la fonction tissulaire) est l'objectif ultime d'un tissu dans des organismes multicellulaires.
Dans cette perspective, l'inflammation a vraisemblablement évolué comme une réponse adaptative à un dysfonctionnement tissulaire ou à un déséquilibre homéostatique. Ainsi, alors que l'état de la maladie est un déplacement de l'homéostasie, l'inflammation est la réponse tissulaire pour restaurer l'homéostasie. Cependant, étant donné que les activités inflammatoires sont potentiellement nocives pour l'hôte, celles-ci doivent être étroitement contrôlées pour éviter des dommages tissulaires excessifs.
Les propriétés fonctionnelles des macrophages varient selon leur distribution tissulaire et leur état d’activation.
Il a été montré dans les années 1970 que les macrophages deviennent pleinement microbicides lorsqu’ils sont exposés à deux signaux successifs, une cytokine de type 1, par exemple l’interféron (IFN)- ou le Tumor Necrosis Factor (TNF) et un produit bactérien comme le LP, SLPS mais il est apparu par la suite que l’activation des macrophages par d’autres molécules conduit à un tableau quelque peu différent.
Une classification M1/M2 des macrophages a été proposée ces dernières années sur le modèle de la polarisation lymphocytaire Th1/Th2. Les macrophages activés par la voie classique (cytokines de type 1 et produits microbiens) sont appelés macrophages M1 et ceux qui sont activés par des voies alternatives sont appelés macrophages M2. Macrophages M1 et M2 diffèrent en termes de récepteurs membranaires, de synthèse de cytokines et d’activité fonctionnelle (Fig. 3). Alors que les macrophages M1 sont inflammatoires et microbicides, les macrophages M2 modulent la réponse immune et sont faiblement microbicides. Les macrophages M2 incluent au moins trois sous-populations : les macrophages M2a induits par l’interleukine l’IL-4 et l’IL-13, les macrophages M2b induits par les complexes immuns, les agonistes des Toll-Like Receptors (TLR) ou les récepteurs de l’IL-1 et les macrophages M2c induits par l’IL-10 et les hormones glucocorticoïdes. En réalité, cette notion de polarisation M1/M2 des macrophages recouvre un continuum d’états fonctionnels (Liu et al.,. 2014). Les macrophages peuvent ainsi être, dans un premier temps, inflammatoires avant de participer à la résolution de l’inflammation, ce qui suggère que les changements fonctionnels des macrophages résultent de modifications de leur microenvironnement.
Le rôle physiologique des sous-ensembles de monocytes in vivo n'est pas complètement défini. Ils peuvent avoir des rôles différents pendant l'homéostasie, la défense en rapport à l’inflammation/ inflammation immunitaire et la réparation tissulaire, en termes de capacité à s'activer et à sécréter des cytokines inflammatoires en réponse à différents stimuli, traitement, et présentation des antigènes, comportement pro-angiogénique et patrouillant (Duque GH, 2014).
Les macrophages sont des acteurs clés dans de nombreux scénarios physiologiques, y compris l'homéostasie tissulaire. En réponse à la lésion, typiquement l'équilibre entre les sous-populations de macrophages passe d'un phénotype M1 (pro-inflammatoire) à un phénotype M2 (anti-inflammatoire) (Italiani et al.,. 2014 ; Wang et al.,. 2014). Dans les scénarios d'ingénierie tissulaire, après l'implantation de n'importe quel dispositif, il est souhaitable d'exercer un contrôle sur cette progression M1-M2 et d'assurer une transition rapide et en douceur de l'étape inflammatoire à la phase de guérison (Jetten et al.,. 2014 ; Alvarez et al.,. 2016) (Fig. 3).
Les recherches s’orientent actuellement sur :
- une nouvelle nomenclature des macrophages avec l’analyse de leurs fonctions ;
- le développement et l'utilisation de stratégies à libération contrôlée pour ajuster l'équilibre entre les phénotypes M1 et M2 dans le contexte des applications d'ingénierie tissulaire ;
- la libération de molécules anti-inflammatoires (y compris les acides nucléiques) et la libération séquentielle de cytokines pour promouvoir un décalage M1-M2 qui soient opportun.
La compréhension de l'équilibre des macrophages M1-M2 et leurs applications sur le plan thérapeutique dans le cadre de l’implantologie osseuse (Fig. 4 et 5) est un véritable défi pour les applications futurs de génie tissulaire et de médecine régénérative (Spiller et al.,. 2015 ; Sridharan et al.,. 2015 ; Ghaemmaghami AM, 2016 ; Rostam et al.,. 2016 ; Scatena et al.,. 2017).
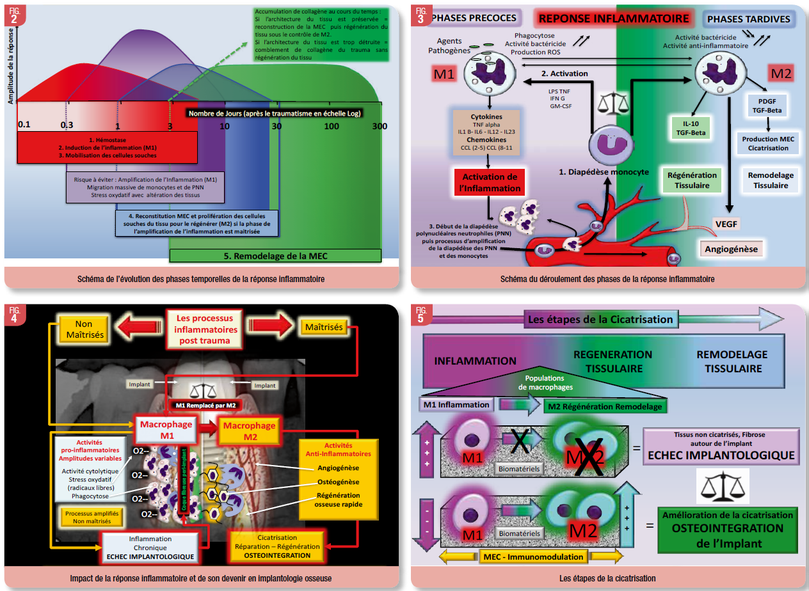
Les principales étapes d’une réponse inflammatoire sont résumées sur la figure 6. La première étape implique l’hémostase avec l’activation des plaquettes et du complément. La seconde étape implique la réponse inflammatoire cellulaire non spécifique avec la phagocytose et la destruction des germes et des débris tissulaires par les monocytes et les polynucléaires neutrophiles. Cette seconde étape peut évoluer alors de deux façons, soit être amplifié avec l’afflux de nouveaux monocytes et polynucléaires neutrophiles, avec le risque d’effets délétères sur les tissus avoisinants, dans l’attente d’une réponse immunitaire adaptative, soit passer directement à la troisième étape avec la réparation de la structure tissulaire, associant l’angiogenèse et à la réparation de la MEC. La quatrième étape impliquera le remodelage du tissu.
Les temps requis pour la reconstruction du tissu osseux après un trauma en implantologie vont donc dépendre de la nature et de la stratégie de l’acte opératoire du praticien. L’apport de plaquettes et de monocytes sur le site du trauma par le saignement du trauma ou par l’apport de Plaquettes RichesRiche en Fibrine (PRF), va venir accélérer le processus de passage de l’étape 2 à l’étape 3. Le PRF apporte de nombreuses plaquettes mais augmente aussi le nombre de macrophages et de leucocytes, cellules importantes pour la défense de l'hôte et la cicatrisation. De plus, les monocytes et plaquettes activées produisent un grand nombre de facteurs de croissance comprenant le facteur de croissance transformant β1 (TGF-β1), le facteur de croissance dérivé des plaquettes (PDGF), le facteur de croissance endothélial vasculaire (VEGF) et le facteur de croissance insulinique-I (IGF- 1) capable de promouvoir davantage la migration cellulaire, la prolifération et la différenciation (Ghanaati SGhanaati S et al., 2014 ; Miron et al., 2017) (Fig. 7). Cet apport de bio facteurs va créer un micro environnement favorable à cette évolution, probablement du fait de l’induction d’une évolution chrono biologique respectueuse de l’évolution du ratio M1/M2, ce qui va donc favoriser un retour rapide à un équilibre homéostatique.
Par ailleurs, les cellules souches mésenchymateuses impliquées dans l’hématopoïèse, l’angiogenèse et l’ostéogénèse sont connues pour avoir aussi de nombreuses fonctions régulatrices au cours des processus inflammatoires donc de la réparation et de la cicatrisation des tissus (Kulkarni et al.,. 2017) (Fig. 8).
Un autre champ d’application de ces données fondamentales est symbolisé par l’emploi, l’impact des ostéotenseursTM sur la bio réparation et surtout sur la bio régénération de tissu osseux. La figure 9 résume les bénéfices observés sur le plan thérapeutiquethérapeutiques : micro trauma, micro thrombus avec la libération des facteurs des plaquettaires activées, mobilisation de cellules souches sur le site du trauma, micro tensions des structures avec leurs impact sur l’ostéogénèse, circulation des liquides interstitiels avec leurs impacts sur les ostéoblastes et cellules souches, développement rapide d’une angiogenèse et d’une ostéogénèse, du fait de l’absence de trauma osseux et d’infection, donc de l’absence d’une amplification de la réponse inflammatoire aigüe avec ses effets délétères.
En conclusion, le tissu osseux représente bien au sein du corps humain un complexe multi cellulaires semi rigide doté de propriétés élastiques en résonance constante avec le monde biologique interne qu’il protège, dans le respect de ses contraintes homéostatiques et de l’environnement externe dans lequel l’homme devra évoluer pour survivre.
Tout dysfonctionnement tissulaire ou tout déséquilibre homéostatique induit physiologiquement un processus inflammatoire. Ce processus biologique a évolué et continue d’évoluer au cours du temps comme une réponse adaptative qui lui permet de maintenir et de rétablir un équilibre homéostatique au sein de ce complexe multi cellulaires. Ainsi, l’inflammation apparait comme une réponse tissulaire naturelle destinée à restaurer une homéostasie. Le devenir des succès en implantologie osseuse et de leur pérennisation passe par le développement de ces connaissances et la maitrise par le praticien de ces interactions tissulaires multiples et complexes.
Bibliographie
-Alvarez MM, Liu JC, Trujillo-de Santiago G, Cha BH, Vishwakarma A, Ghaemmaghami AM, Khademhosseini A. Delivery strategies to control inflammatory response: Modulating M1–M2 polarization in tissue engineering applications. Journal of Controlled Release (2016) 28, 349-363.
-Dunac A, Frelin C, Popolo-Blondeau M, Chatel M, Mahagne MH, Philip PJM. Neurological and functional recovery in human stroke are associated with peripheral blood CD34+ cell mobilization. J Neurol. (2007), 254(3):327-32.
-Duque GH, Descoteaux A. Macrophage Cytokines: Involvement in Immunity and Infectious Diseases. In Frontiers in Immunology, October 2014, 5(491):491.
-Frenette PS, inho S, Lucas D, Scheiermann C. Mesenchymal stem cell: keystone of the hematopoietic stem cell niche and a stepping-stone for regenerative medicine. Annu Rev Immunol.(2013), 31: 285-316.
-Frost HM. Wolff's Law and bone’s structural adaptations to mechanical usage: an overview for clinicians. Angle Orthod (1994); 64:175-188.
-Frost HM. Some ABCs of skeletal pathophysiology. III: Bone balance and the delta B.BMU. Calci Tis Int (1989); 45:131-133.
-Frost HM. Presence of microscopic cracks in vivo in bone. Henry Ford Hosp Med Bull (1960); 8:25-35.
Ghaemmaghami AM. The impact of surface chemistry modification on macrophage polarisation. Immunobiology (2016) 221, 1237-1246.
-Ghanaati S, Booms P, Orlowska A, Kubesch AOrlowska A, Kubesch A, Lorenz J, Rutkowski J, Landes C, Sader RRutkowski J, Landes C, Sader R, Kirkpatrick C, Choukroun J.Choukroun J. Advanced platelet-rich fibrin: a new concept for cell-based tissue engineering by means of inflammatory cells. J Oral Implantol. (2014), 40(6):679-89.
-Haylock DN, Nilsson SK. Stem cell regulation by the hematopoietic stem cell niche.Cell Cycle. (2005) Oct; 4(10):1353-5.
-Jetten N, Verbruggen S, Gijbels MJVerbruggen S, Gijbels MJ, Post MJ, De Winther MP, Donners MM.Donners MM. Anti-inflammatory M2, but not pro-inflammatory M1 macrophages promote angiogenesis in vivo. Angiogenesis. (2014) Jan; 17 (1):109-18.
-Italiani P, Borashi D. From Monocytes to M1/M2 Macrophages: Phenotypical vs. Functional Differentiation. Front Immunol. (2014) Oct 17; 5:514.
-Kulkarni R, Bajaj M, Ghode S, Jalnapurkar S, Limaye L-Kulkarni R, Bajaj M, Ghode S, Jalnapurkar S, Limaye L, Kale VP. Intercellular Transfer of Microvesicles from Young Mesenchymal Stromal Cells Rejuvenates Aged Murine Hematopoietic Stem Cells. Stem Cells. Version of Record online: 22 dec 2017 DOI: 10.1002/stem.2756.
-Levin M, Pezzulo G, Finkelstein JM. Endogenous Bioelectric Signaling Networks. Exploiting Voltage Gradients for Control of Growth and Form. Annu Rev Biomed Eng. (2017) Jun 21; 19:353-387.
-Liu YC, Zou XB, Chai YF, Yao YM. Macrophage polarization in inflammatory diseases. Int J Biol Sci. (2014) May 1; 10(5):520-9.
-Miron RJ, Zucchelli G, Pikos MA, Salama M, Lee S, Guillemette V, Fujioka-Kobayashi M, Bishara M, Zhang Y, Wang HL, Chandad F, Nacopoulos C, Simonpieri A, Aalam AA, Felice P, Sammartino G, Ghanaati S, Hernandez MA, Choukroun J. Use of platelet-rich fibrin in regenerative dentistry: a systematic review. Clin Oral Investig. (2017) Jul; 21(6):1913-1927.
-McLaughlin KA, Levin M. Bioelectric signaling in regeneration: Mechanisms of ionic controls of growth and form. Dev Biol. (2018) Jan 15; 433(2):177-189.
-Nilsson SK, Johnston HM, Whitty GA, Williams B, Webb RJ, Denhardt DT, Bertoncello I, Bendall LJ, Simmons PJ, Haylock DN. Osteopontin, a key component of the hematopoietic stem cell niche and regulator of primitive hematopoietic progenitor cells. Blood. (2005) Aug 15; 106(4):1232-9.
-Quiros-Gonzalez I, Yadav VK.Yadav VK. Central genes, pathways and modules that regulate bone mass. Arch Biochem Biophys, (2014) Nov 1; 561:130-6.
-Rostam HM, Singh S, Salazar F, Magennis P, Hook A, Singh T, Vrana NE, Alexander MR, Ghaemmaghami AM. The impact of surface chemistry modification on macrophage polarisation.
Immunobiology. (2016) Nov; 221(11):1237-46.
-Rubin CT, Lanyon LE. Regulation of bone mass by mechanical strain magnitude. Calci Tis Intern (1985); 37:411-417.
-Scatena M, Eaton KV, Jackson MF, Lund SA, Giachelli CM. Macrophages: The Bad, the Ugly, and the Good in the Inflammatory Response to Biomaterials. In: Corradetti B. (eds) The Immune Response to Implanted Materials and Devices (2017). Springer, Cham.
-Smith EL, Gilligan C. Dose-response relationship between physical loading and mechanical competence of bone. Bone (1996); 18 (1 Suppl):455-505.
-Spiller KL, Nassiri S, Witherel CE, Anfang RR, Ng J, Nakazawa KR, Yu T, Vunjak-Novakovic G. Sequential delivery of immunomodulatory cytokines to facilitate the M1-to-M2 transition of macrophages and enhance vascularization of bone scaffolds. Biomaterials. (2015) Jan; 37:194-207.
-Sridharan R, Andrew R. Cameron AR, Daniel J. Kelly DJ, Kearney CJ and FJ. O’Brien. Biomaterial based modulation of macrophage polarization: a review and suggested design principles. Materials Today, (2015):18, 6: 313-325.
-Sundelacruz S, Levin M, Kaplan DL. Comparison of the depolarization response of human mesenchymal stem cells from different donors. Sci Rep. 2015 Dec 14; 5:18279.
-Sundelacruz S, Levin M, Kaplan DL. Role of membrane potential in the regulation of cell proliferation and differentiation. Stem Cell Rev (2009) Sep; 5(3):231-46.
-Vico L, Collet P, Guignandon A, Lafage-Proust MH, Thomas T, Rehaillia M, Alexandre C. Effects of long-term microgravity exposure on cancellous and cortical weight-bearing bones of cosmonauts. Lancet (2000), 6 (355):1607-1611.
-Wang N, Loang H, Zen K. Molecular mechanisms that influence the macrophage M1–M2 polarization balance. Front Immunol (2014): 5, 1-9.
Intercellular Transfer of Microvesicles from Young, Mesenchymal Stromal Cells Rejuvenates Aged, Murine Hematopoietic Stem Cells
-Rohan Kulkarni, Anmohan Bajaj, Suprita Ghode, Sapana Jalnapurka, L. Alita Limaye, Vaijanyanti Wiskott, Intercellular Transfer of Microvesicles from Young, Mesenchymal Stromal Cells Rejuvenates Aged, Murine Hematopoietic Stem Cells
- Rohan Kulkarni, Anmohan Bajaj, Suprita Ghode, Sapana Jalnapurka, L. Alita Limaye, Vaijanyanti Wiskott Intercellular Transfer of Microvesicles from Young, Mesenchymal Stromal Cells Rejuvenates Aged, Murine Hematopoietic Stem Cells
- Rohan Kulkarni, Anmohan Bajaj, Suprita Ghode, Sapana Jalnapurka, L. Alita Limaye, Vaijanyanti Wiskott Aspect biologique de la réponse osseuse aux contraintes mécaniques. Rev Odont Stomat (2011), 40:76-88.
-Wolff J.D. Das Gesetz der Transformation der Knochen. Ed: Hirschwald Berlin 1892.
-Yu VW, Lymperi S, Ferraro F, Scadden DT. Transcriptome comparison of distinct osteolineage subsets in the hematopoietic stem cell niche using a triple fluorescent transgenic mouse model. Genom Data. (2015) Jun 5; 5:318-9.
