Les effets des différentes longueurs d’onde laser sur la cicatrisation et la régénération osseuses
Dr Susanne PUNGS
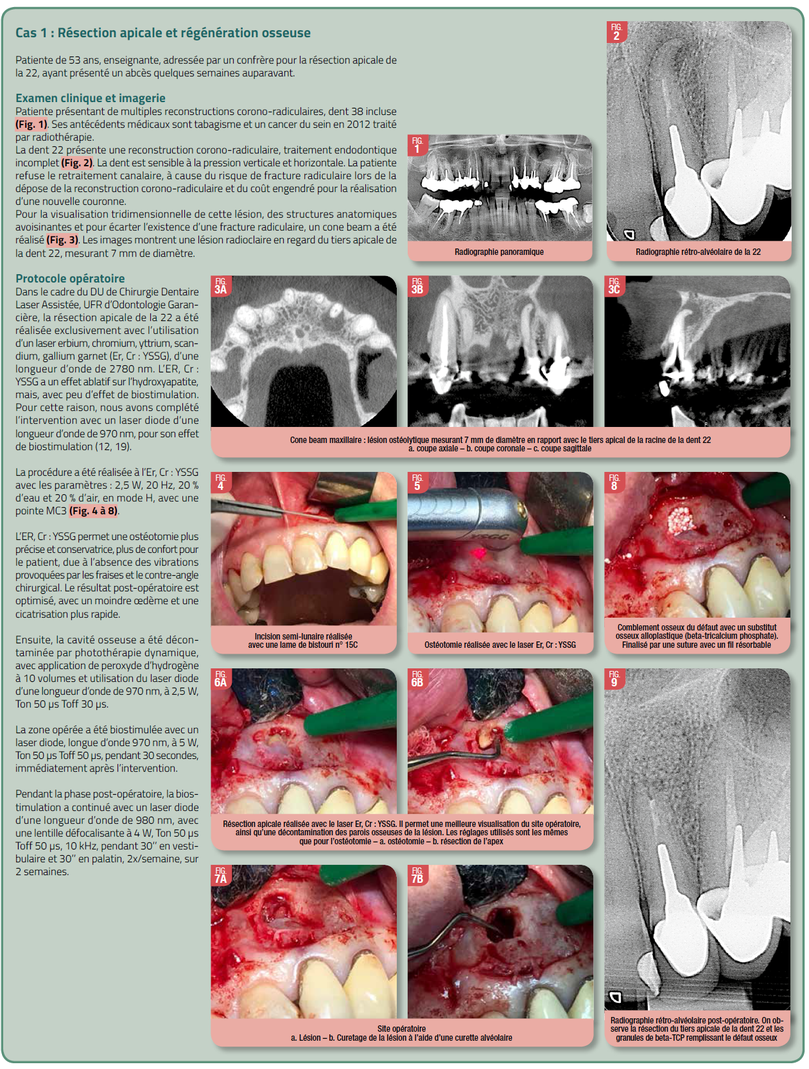
Dossier Spécial Laser - AO News #18

Introduction
Les défauts osseux de la crête alvéolaire représentent un sujet complexe pour la réhabilitation prothétique dans la pratique dentaire. L’os autogène ou les substituts osseux de différentes origines sont la méthode la plus souvent employée pour le traitement de ces défauts. Les principaux avantages des biomatériaux par rapport aux greffes osseuses autogènes sont la disponibilité du volume nécessaire et l’absence d’un site donneur, résultant en une moindre morbidité post-opératoire.
Au niveau histologique et cellulaire le processus de cicatrisation osseuse a été bien étudié. Il comprend la formation et la maturation d’un caillot sanguin, l’infiltration de fibroblastes, l’établissement d’une matrice provisoire qui sera remplacée par de l’os néo-formé, conduisant, finalement, à la formation de l’os spongieux et de la moelle osseuse (5).
L’ostéogenèse et l’angiogenèse sont deux processus étroitement liés et impliqués dans la croissance, la réparation et le remodelage osseux (15). Au niveau moléculaire, actuellement, peu d’études existent sur l’expression génétique menant à la cicatrisation et la réparation osseuses. Pendant le processus de cicatrisation de l’os alvéolaire, des plaquettes, diverses protéines de la matrice extra-cellulaire et des facteurs de croissance osseuse (BMPs) sont exprimés, initiant l’ostéogenèse et l’angiogenèse (9). Différentes études ont permis de mettre en évidence que la biostimulation aux lasers diode augmente l’expression des gènes de l’ostéogenèse RUNx2, Col1, BMPs, OCN, PDGF-B, VEGF (5,11, 13, 24i), exerçant, ainsi, une action d’ostéoinduction (18).
Actuellement, des approches thérapeutiques pour accroître le potentiel régénératif osseux sont disponibles et continuent d’être optimisées. Parmi celles-ci, l’utilisation des lasers de différentes longueurs d’onde est une technique prometteuse. Utilisée dans plusieurs domaines médicaux, y compris la chirurgie dentaire, dans le traitement de défauts osseux provoqués par des extractions dentaires, infections, kystes ou traumatismes, elle apporte des résultats significatifs.
Les lasers diode, qui émettent dans le proche infrarouge, entre 800 et 1000nm, ont un effet de biostimulation. Le terme « biostimulation » est employé pour décrire l’action du laser sur la modification de l’équilibre cellulaire (19). Elle favorise les effets de photobiomodulation cellulaire et, également, les réponses thérapeutiques provoquées par des réactions photochimiques, photoélectriques et photoénergétiques (3).
Le mécanisme exact d’action des lasers sur la réparation osseuse n’est pas encore précisé scientifiquement. Des études in vivo et in vitro montrent que les lasers diode ont divers effets adjuvants dans le cours de ce processus: promouvoir l’angiogenèse (26), favoriser la prolifération cellulaire (23), accroître l’apport sanguin local, amplifier la croissance, la prolifération et la différentiation des ostéoblastes (11, 17) et promouvoir la respiration mitochondriale et la synthèse d’ATP (14, 25). Il en résulte une accélération de la cicatrisation des tissus mous et de la réparation osseuse et nerveuse, ainsi qu’une réduction des suites opératoires (12).
A ce jour, un consensus sur un protocole de biostimulation pour la réparation osseuse n’est pas établi. Des études ont été réalisées avec des lasers diodes à des longueurs d’onde variant de 810nm à 980nm, avec des protocoles de durée et doses d’irradiation très différents entre eux. Des recherches effectuées avec un laser diode d’une longueur d’onde de 830nm ont montré un recrutement précoce de cellules inflammatoires, l’accélération de la néoformation osseuse, ainsi qu’une augmentation significative de l’expression des gènes liés à l’inflammation et à l’angiogenèse chez les souris (14, 26). D’autres analyses réalisées avec un laser diode d’une longueur d’onde de 940nm ont observés l’augmentation significative de l’expression des gènes de différentiation des ostéoblastes, comme Runx-2, ALP et collagène type 1 (11).
Cependant, des effets positifs sur la cicatrisation et la réparation osseuse ont été vérifiés dans de nombreuses études in vivo et in vitro : modulation de l’inflammation du tissu de cicatrisation, la stimulation de la prolifération cellulaire et l’augmentation de la densité osseuse, accélérant le processus de régénération tissulaire (11, 14, 17, 24, 25, 26).
Une action très intéressante des lasers diode est celle d’accélérer la cicatrisation des défauts osseux traités avec des matériaux de substitution osseuse, en augmentant l’activité des ostéoblastes et des ostéoclastes in situ (11). Leur utilisation clinique peut s’avérer très efficace pour la régénération osseuse, notamment chez les patients présentant des altérations du métabolisme osseux, comme, par exemple, les fumeurs, les sujets ayant subi une radiothérapie cervico-faciale, et ceux sous bisphosphonates.
Deux cas cliniques vont illustrer ci-après l’utilisation des lasers de différentes longueurs d’onde dans la chirurgie, la cicatrisation et la régénération osseuses.

Discussion
Les deux cas cliniques présentés dans cet article, illustrent l’utilisation de lasers de différentes longueurs d’onde dans la chirurgie osseuse, ayant pour objectif l’économie tissulaire, la décontamination de la zone infectée, la rapidité et la qualité de la réparation osseuse.
Chaque laser présente une longueur d’onde spécifique. Certains rayonnements peu ou pas absorbés par certains tissus les traverseront pour aller céder leur énergie progressivement en profondeur, alors que d’autres ne pourront pas y pénétrer, l’action du rayonnement étant très efficace sur la surface d’impact de celui-ci. C’est la longueur d’onde de chaque laser qui permet cette particularité essentielle (19). C’est pourquoi, des lasers de différentes longueurs d’onde ont été employés dans cet article, selon l’effet souhaité. Des lasers photo-ablatifs (CO2 et Er,Cr:YSSG) ont été utilisés pour l’élimination des tissus infectés, objectivant la préservation des structures anatomiques avoisinantes du site opératoire et pour la décontamination superficielle du défaut osseux. Alors que des lasers pénétrants (diodes), ont été choisis pour leurs effets photochimiques, thermiques et biostimulants, permettant la décontamination en profondeur du défaut osseux, la création d’une membrane biologique, et, aussi, favoriser la cicatrisation et la régénération osseuses.
L’augmentation de la prolifération cellulaire et l’accélération du métabolisme tissulaire sont les effets physiologiques plus importants de la biostimulation, contribuant à l’amélioration du processus de cicatrisation. Dans ce contexte, plusieurs études ont montré que les lasers diode ont un effet positif sur la cicatrisation osseuse (3, 15, 23), en stimulant, entre autres, l’expression des gènes de l’ostéogenèse participant à la réparation osseuse (15) et l’activité des ostéoblastes (24). Ce qui peut expliquer les résultats positifs de cette thérapie sur la cicatrisation osseuse, avec la modulation de l’inflammation (16) et le recrutement précoce des cellules ostéoprogénitrices, augmentant ainsi le taux de néoformation osseuse (7). Des auteurs ont suggéré que la biostimulation altère le comportement cellulaire en influençant la respiration mitochondriale ou les canaux de calcium de la membrane cellulaire. Cela peut stimuler la synthèse de collagène, l’angiogenèse, et la libération de facteurs de croissance, qui vont favoriser la cicatrisation tissulaire (16, 25).
L’importance du choix d’un niveau adéquat d’énergie irradiée a été discutée par plusieurs auteurs. Cependant un protocole idéal de biostimulation envisageant l’accélération de la réparation osseuse n’a pas encore été établi. Cela peut être attribué aux différentes longueurs d’onde de laser diode disponibles et les différents types de protocoles utilisés. Plusieurs études ont décrit les effets de la biostimulation aux lasers diode de longueurs d’onde variant de 830nm à 980nm (11, 14, 16, 23). Les protocoles, extrêmement différents entre eux, ne permettent pas une comparaison des résultats.
Les effets de la biostimulation dépendent des paramètres d’irradiation du laser diode: la longueur d’onde, la dose, l’intensité du rayon laser, le diamètre du point irradié, le temps total et les modes d’irradiation - unique ou répétitive (10, 21). Une étude, sur l’irradiation avec le laser diode à 820nm sur des sutures palatines pendant l’expansion maxillaire rapide chez des souris, a observé l’accélération de la régénération osseuse dans le groupe laser-irradié avec des doses de 5 et 6,30 J/cm2 (1). Concernant les tissus mous, l’irradiation au laser diode avec une densité d’énergie de 3,7 à 5,0J/cm2 pendant 7 jours, a provoqué la stimulation maximale de la cicatrisation des plaies chez des souris diabétiques. Les doses en dehors de ces paramètres n’ont pas apporté d’effets significatifs (6, 17). L’effet du traitement laser sur la croissance cellulaire est dose-dépendant (2, 20). Un temps d’irradiation plus long, avec des irradiations répétitives au laser diode de 980nm, augmente l’expression des protéines de l’ostéogenèse et accélère la cicatrisation alvéolaire significativement chez les souris (15).
Les effets de la biostimulation sont modulés par de multiples facteurs, comme la profondeur du tissu cible et la longueur d’onde, la localisation et la nature du défaut, la diversité des cellules, l’état physiologique du patient et les paramètres laser. Par conséquent, une meilleure compréhension des mécanismes cellulaires et biochimiques de la biostimulation est nécessaire, pour mieux évaluer les résultats expérimentaux et pour établir un protocole de biostimulation reproductible.
Concernant les cas présentés dans cet article, le protocole de biostimulation utilisé a été l’irradiation avec un laser diode 970nm pendant 1 minute (30 secondes en vestibulaire, 30 secondes en palatin) en post-opératoire immédiat, ensuite 2x/semaine pendant 2 semaines avec un laser diode de 980nm pendant, également, 1 min (30sec en vestibulaire et 30sec en palatin). Ce protocole, utilisant des irradiations répétitives pendant la phase initiale de la cicatrisation osseuse, est en concordance avec les résultats des études cités ci-dessus. Nous avons observé une réparation osseuse complète sur le site de la communication bucco-sinusienne chez un patient fumeur en 6 semaines. Des études ont démontrés que les patients fumeurs présentent une moindre densité de l’os alvéolaire que les non-fumeurs, et que, à la suite des extractions dentaires, les fumeurs présentaient une diminution de la qualité et de la densité osseuses et une perte plus importante de la hauteur de la crête osseuse que les non-fumeurs (22). Il a été observé, également, que le tabagisme affecte négativement l’expression du mRNA de l’ostéocalcine (OCN), et favorise l’expression de collagène1 (Col-1). Col1est présent de façon abondante dans l’os. Cette molécule participe aux stades initiaux de formation osseuse et, bien qu’essentielle, elle ne participe pas à son processus de minéralisation. En contrepartie, l’OCN participe directement au processus de minéralisation osseuse. Son expression étant réduite chez les fumeurs, cela pourrait expliquer l’effet du tabac sur la réduction de la minéralisation osseuse chez ces patients (4). La biostimulation au diode favorise, entre autres, l’expression d’OCN (15). Ce fait, pourrait expliquer les effets positifs de la biostimulation sur la vitesse et la qualité de la cicatrisation osseuse de notre patient.
Conclusion
Les bénéfices de l’utilisation des lasers de différentes longueurs d’onde sur les diverses étapes de la chirurgie, de la cicatrisation et de la régénération osseuses sont multiples: préservation des structures anatomiques avoisinantes et désinfection du site opératoire, stimulation de la réparation osseuse et l’accélération de l’intégration des biomatériaux au défaut osseux. La biostimulation, en plus de ses propriétés anti-inflammatoires et antalgiques connues, présente des propriétés d’ostéogenèse, déclenchant l’expression des molécules médiatrices de la formation osseuse. En outre, les données scientifiques encouragent l’utilisation de la biostimulation en chirurgie dentaire chez les fumeurs et les patients présentant des pathologies systémiques menant à une cicatrisation osseuse altérée. A la lumière des résultats obtenus dans la littérature scientifique, nous disposons désormais de données suffisantes pour élaborer des études standardisées des protocoles de biostimulation, concernant spécifiquement la réparation et la régénération osseuses, pour créer un protocole reproductible, conforme aux données acquises de la science.
Bibliographie
1. Altan AB, Bicakci AA, Avunduk MC, Esen H. The effect of dosage on the efficiency of LLLT in new bone formation at the expanded suture in rats. Lasers Med Sci. 2015 Jan;30(1):255-62.
2. Al-Watban FA, Andres BL. Laser biomodulation of normal and neoplastic cells. Lasers med Sci 2012 27:1039-1043.
3. Angeletti P, Pereira MD, Gomes HC, Hino CT, Ferreira LM. Effect of low-level laser therapy (GaAlAs) on bone regeneration in midpalatal anterior suture after surgically assisted rapid maxillary expansion. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010 Mar; 09(3):e38-46
4. Campos JM, Prati AJ, Cirano FR, Pimentel SP, Pastore GP, Pecorari VG, Ribeiro FV, Casati MZ, Casarin RC.Smoking Modulates Gene Expression of Type I Collagen, Bone Sialoprotein, and Osteocalcin in Human Alveolar Bone. Oral Maxillofac Surg. 2015 Nov;73(11):2123-31.
5. Cardaropoli G, Araujo M, Lindhe J. (2003). Dynamics of bone tissus formation in tooth extraction sites. An expérimental study in dogs. J Clin Periodontol 30:809-818.
6. Chung TY, Peplow PV, Baxter GD. Laser photobiostimulation of wound healing: defining a dose response for splinted wounds in diabetic mice. Lasers Surg med 42:656-664.
7. Fávaro-Pípi E, Ribeiro DA, Ribeiro JU, Bossini P, Oliveira P, Parizotto NA, Tim C, de Araújo HS, Renno AC. Low-level laser therapy induces differential expression of osteogenic genes during bone repair in rats. Laser Surg. 2011 May;29(5):311-7.
8. Herford AS, Dean JS. Complications in bone grafting. Oral Maxillofac Surg Clin North Am. 2011 Aug;23(3):433-42.
9. Lin Z, Rios HF, Volk SL, Sugai JV, Jin Q, Giannobile Wv. (2011). Gene Expression Dynamics During Bone healing and Osseointegration. J Periodontal. 82(7):1007-1017.
10. Lomke MA. Clinical Application of Dental Lasers. Gen Dent, 2009 57:47-59.
11. Manzano-Moreno FJ, Medina-Huertas R, Ramos-Torrecillas J, García-Martínez O, Ruiz C. The effect of low-level diode laser therapy on early differentiation of osteoblast via BMP-2/TGF-β1 and its receptors. J Craniomaxillofac Surg. 2015 Nov;43(9):1926-32.
12. Mester E, Mester AF, Mester A. 1985. The biomedical effects of laser application. Lasers Surg Med 5:31-39.
13. Mozzati M, Martinasso G, Cocero N, Pol R, Maggiora M, Muoio, G, Canuto RA. Superpulsed laser therapy on healing process after tooth extraction in patients waiting for liver transplantation. Lasers Med Sci (2012) 27:353-359.
14. Oliveira Gonçalves JB, Buchaim DV, Souza Bueno CR, Jomini KT, Barravieira B, Ferreira Junior RS, Andreo JC, Rodrigues AC, Cestari TM, Buchaim RL; (2016). Effects of low-level laser therapy on autogenous bone graft stabilized with a new heterologous fibrin sealant. J Photochem Photobiol B 206 Sep;162:663-8.
15. Park JB, Ahn SJ, Kang YG, Kim EC, Her JS, Kang KL. Effects of increased low-level diode laser irradiation time on extraction socket healing in rats. (2015). Lasers Med Sci, 30:719-726.
16. Park JJ, Kang KL. Effect of 980-nm GAIAs diode laser radiation on healing of extraction sockets in streptozotocin-induced rats: a pilot study. Lasers Med Sci. 2012 Jan;27(1):223-30.
17. Peplow PV, Chung TY, Baxter GD. Laser photobiomodulation of proliferation of cells in culture: a review of human and animal studies. Photomed Laser Surg. 2010 Aug;28 Suppl 1:S3-40.
18. Pinheiro AL, Gerbi ME. Photoengineering of bone repair processes. Laser Surg. 2006 Apr;24(2):169-78.
19. Rey G., Missika, P. Les lasers et la chirurgie dentaire. Editions CDP. 2010.
20. Rossini PS, Renno AC, Ribeiro DA, Fangel R, Ribeiro AC, Lahoz Mde A, Parizotto NA. Low level laser therapy (830nm) improves bone repair on osteoporotic rats: similar outcomes at two different dosages. 2012 Exp Gerontol 47:136-142.
21. Saito S1, Shimizu N . Stimulatory effects of low-power laser irradiation on bone regeneration in midpalatal suture during expansion in the rat. J Orthod Dentofacial Orthop. 1997 May;111(5):525-32
22. Saldanha JB1, Casati MZ, Neto FH, Sallum EA, Nociti FH Jr. Smoking may affect the alveolar process dimensions and radiographic bone density in maxillary extraction sites: a prospective study in humans. Oral Maxillofac Surg. 2006 Sep;64(9):1359-65.
23. Santinoni CD, Oliveira HF, Batista VE, Lemos CA, Verri FR. Influence of low-level laser therapy on the healing of human bone maxillofacial defects: A systematic review. Photochem Photobiol B. 2017 Apr;169:83-89.
24. Saracino S, Mozzati M, Martinasso G, Pol R, Canuto RA, Muzio G. Superpulsed laser irradiation increases osteoblast activity via modulation of bone morphogenetic factors. Lasers Surg Med. 2009 Apr;41(4):298-304.
25. Silveira PC, Silva LA, Fraga DB, Freitas TP, Streck EL, Pinho R. Evaluation of mitochondrial respiratory chain activity in muscle healing by low-level laser therapy. J Photochem Photobiol B. 2009 May 4;95(2):89-92.
26. Tim CR, Bossini PS, Kido HW, Malavazi I, von Zeska Kress MR, Carazzolle MF, Parizotto NA, Rennó AC. Effects of low level laser therapy on inflammatory and angiogenic gene expression during the process of bone healing: A microarray analysis. J Photochem Photobiol B. 2016 Jan;154:8-15
Retour aux Articles Scientifiques
