À propos d’un cas clinique de péri-implantite traitée par l’association laser diode et Erbium yag (Laser Erbium Cr.Ysgg)
AO News #61 - Octobre 2023
Introduction
Les lasers sont déjà très utilisés dans d’autres disciplines médicales telles que l’ophtalmologie et la dermatologie. En stomatologie et odontologie, l’utilisation de cette technologie bien connue physiquement reste limitée mais le nombre d’articles bibliographiques sur le sujet témoignent de l’intérêt croissant de cette assistance laser dans les domaines de l’endodontie, de la parodontologie, et de l’implantologie. Voici un cas de péri-implantite traitée par l’association de deux lasers ayant des propriétés physiques différentes et donc des actions et des réponses biologiques différentes.
La prévalence actuelle (39) de la péri-implantite (1,3,4) nécessite une optimisation des traitements, et mieux, de leur prévention. L’étiologie plurimicrobienne (5,6,7,29) et l’histologie de l’environnement implantaire (tissus mous et osseux) nous amène à considérer les lasers comme des armes supplémentaires dans notre arsenal thérapeutique. De nombreuses études montrent que grâce aux lasers nous aurons une destruction des bactéries et des toxines, une diminution de l’inflammation rapide, une diminution des douleurs et des œdèmes post opératoires, une cicatrisation plus rapide et à moyen terme un gain osseux.
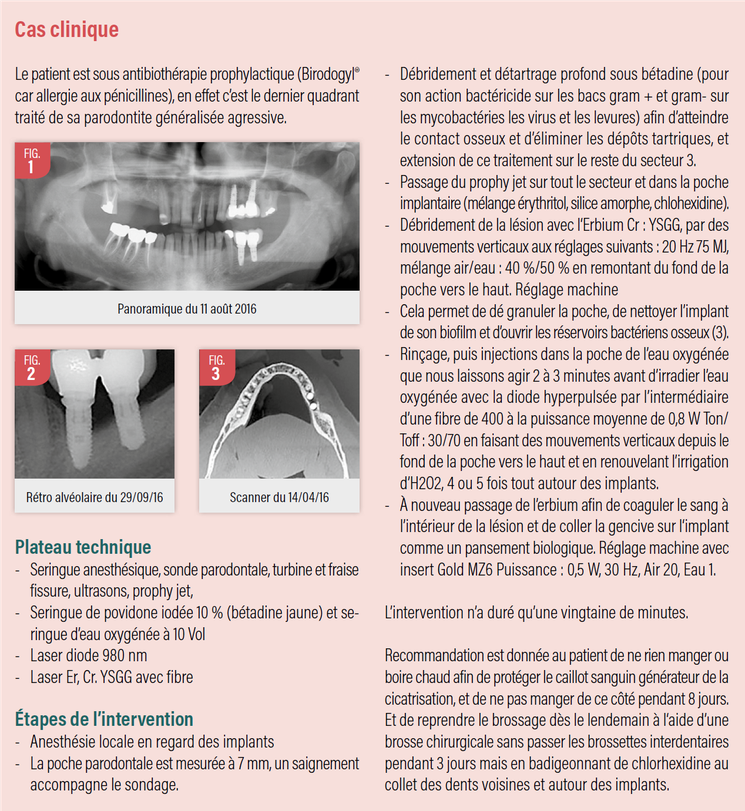
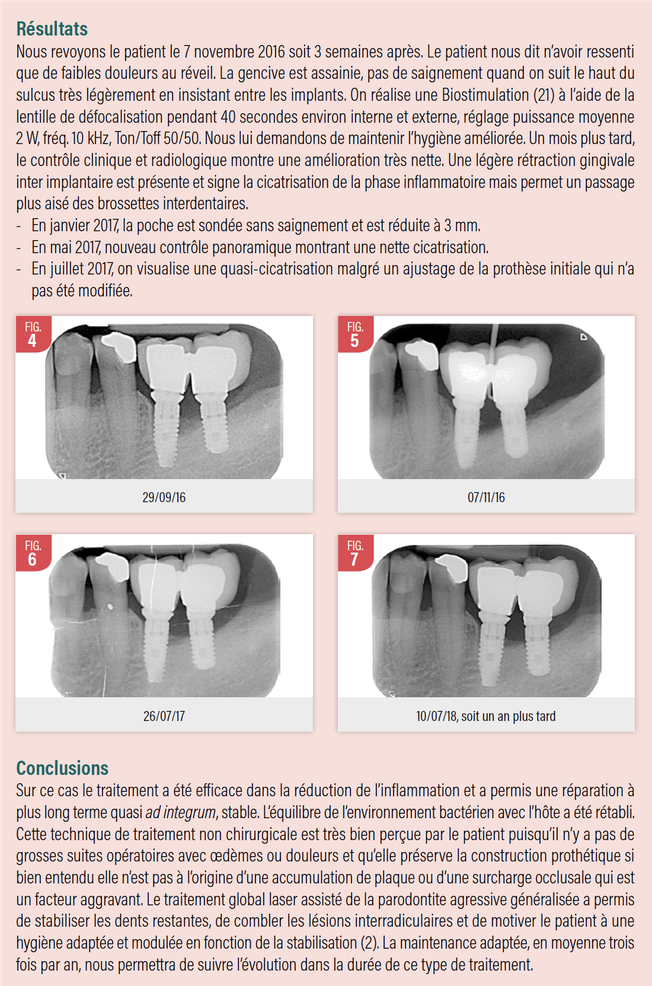
A partir de ces éléments voici un cas clinique de péri-implantite chez un patient présentant une parodontite agressive généralisée. Les implants posés trois ans auparavant en 36 37 sont des implants distaux sans surcharge occlusale. La lésion concerne la 1/2 de la longueur des implants 36 et 37 de longueur respective 12 et 10 mm avec une perte osseuse de type II selon la classification donnée par J.L. Giovannoli et S. Renver. (1)
Le 18 octobre 2016, ce cas est traité par abord non chirurgical assisté d’un laser Erbium et d’un laser diode 980nm en première intention car le patient souhaite, si possible, ne pas réinvestir dans une restauration prothétique compte tenue de la pose assez récente de ses implants. Ce patient est déjà initié aux soins laser assistés puisque sa parodontite a été traitée par la technique photo dynamique PDT décrite par G. Rey (2) sur les secteurs 1,2 et 4 après prélèvement biologique et étude ADN des souches bactériennes et confirmation de la prévalence des complexes rouge et orange de Socranski.
Modalités du choix de ces deux lasers
Les lasers émettent un énergie photonique organisée en faisceaux lumineux cohérents monochromatiques omnidirectionnels et avec une luminance élevée.
Nous avons choisi d’utiliser ici deux types de laser, l’Erbium (longueur d’onde 2940nm) et le diode super pulsé (980nm), pour leur complémentarité. En effet, ils ont des effets physiques différents en fonction de leur longueur d’onde, comme les tableaux suivants nous l’indiquent.
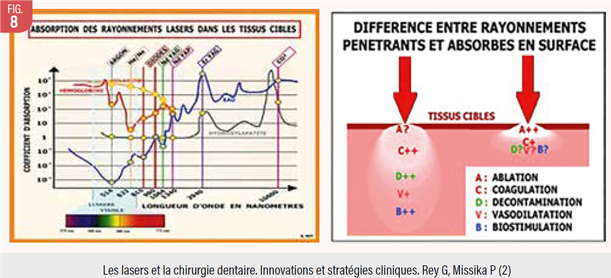
Le premier tableau indique les courbes d’absorption dans les tissus et montre l’affinité des rayons d’un Erbium pour l’eau et l’hydroxyapatite. L’Er,Cr;YSGG que nous avons utilisé (longueur d’ onde 2780nm ) est moins absorbé dans l’eau que l’Er,Yag mais il reste dans la même catégorie. Ce sont les lasers les plus absorbés par l’eau.
Ils ont un effet photo ablatif sur les tissus mous très important d’où leur intérêt dans le débridement de la lésion et la dégranulation du tissu inflammatoire péri-implantaire, mais aussi sur les tissus durs dentaires et osseux (ici réservoirs bactériens osseux (3)) car leur absorption dans l’hydroxyapatite est importante.
La volatilisation du biofilm sans contact direct avec l’implant permet une désinfection des spires en complément de l’aéropolisseur que nous avons passé dans la poche sans augmentation de température pour les tissus voisins compte tenu du réglage de la machine à 1,5W 20HZ 75mJ, ni modification thermique de la structure de la surface implantaire.
L’effet décontaminant de l’Erbium se fait grâce à la réaction explosive due à l’absorption de l’énergie photonique par l’eau qui entraine un éclatement des parois cellulaires des bactéries du biofilm (36). Le rayonnement de ce laser a une puissance de crête importante, en utilisant une fibre au contact des tissus on concentre le faisceau laser sur le tissu à traiter afin d’obtenir des champs électriques très importants qui induisent une haute densité d’électrons libres dans les tissus cibles. Les molécules d’eau absorbent cette énergie et provoquent des micros explosions à l’origine de cet effet photo ablatif (ici la poche était accessible jusqu’au fond par le saphir car la lésion était en forme de cratère élargi, ce n’est pas toujours le cas et alors un lambeau d‘accès sera préférable). Un spray d’eau accompagne le travail et permet de libérer de l’oxygène actif et bactéricide, de l’ozone, et de diminuer les effets thermiques pour épargner les tissus voisins de la zone interactive où se produit le rayonnement. Ces lasers par leur effet canon éliminent les toxines, les lipposaccharides et le tartre très efficacement.
Il est possible de faire varier l’intensité du pulse pour diminuer le stress thermique sur les tissus durs et permettre un saignement qui aura un effet de bio stimulation sur la cicatrisation osseuse en accélérant la prolifération ostéoblastique.
Ce laser est un laser dit absorbé qui ne sera actif que sur 2 microns de profondeur de tissu et grâce à son effet canon son action peut être évaluée à une profondeur de 0,4mm. En fin de traitement nous avons utilisé l’erbium pour faire un pansement biologique en collant la muqueuse sur l’implant par un effet thermique léger de coagulation de surface en réduisant très nettement le spray d’eau.
Le laser diode, lui, est pénétrant sur 1 à 2cm de profondeur de tissus. Il est très absorbé par l’hémoglobine et la mélanine et bien dans l’eau. Sa haute absorption par les pigments explique l’effet de destruction sur les cellules pigmentées et l’effet de biostimulation sur les cellules de défense des tissus environnants.
Mais l’action bactéricide à proprement parlé des lasers sera réalisée alors par l’utilisation du laser diode avec PDT (Photo Thérapie Dynamique) (20) à l’aide d’un photo-sensibilisant non coloré (afin de ne pas diminuer l’absorption de l’énergie par un colorant). Le péroxyde d’hydrogène (à 10Vol pour éviter les propriétés toxicologiques des fortes doses) incolore pénètre aisément les membranes et se décompose rapidement en oxygène et en eau sous l’action des péroxydases des organismes vivants aérobies. La technique de traitement parodontal laser assisté décrite par G. Rey (2000 et 2001) fait suite à de précédentes études sur l’activation et les effets bactéricides de la PDT associée le plus souvent à des photosensibilisateurs colorés (bleu de méthylène, de toluidine …).
L'impact du rayonnement sur l’oxygène, accepteur d’énergie le transforme par photo oxydation en oxygène singulet énergiquement très actif, mais très instable (d’où l’intérêt des hautes fréquences). Sa forte réactivité peut induire un stress oxydant conduisant à la mort cellulaire permettant une action bactéricide décontaminante.
Nous avons utilisé une fibre de 400mm dont la longueur permet facilement un accès au fond de la poche (à condition d’avoir un bon accès pour ne pas la casser) et l’avons déplacée tout autour de la surface implantaire afin de réduire l’échauffement et toujours avec une haute fréquence permettant d’amener un maximum d’énergie sur le site à traiter mais avec des temps de repos qui nous permettent aussi de renouveler l’apport d’H2O2 dans la poche.
Comme tous les lasers pénétrants, le laser diode a un effet thermique qui peut être utile pour augmenter la vascularisation de la lésion traitée afin d’amener in situ les éléments actifs de la cicatrisation. C’est l’effet photo dynamique sous la zone de coagulation.
Il a en sus un effet biostimulant cellulaire. En effet, avec une augmentation de température d’environ 13 degrés, l’énergie communiquée aux tissus induit la production de protéines de choc thermique ; les HSP provoquant l’apparition de collagénases de type 1 favorisant la cicatrisation tissulaire. L’effet du rayonnement sur les mitochondries permet la transformation de l’ADP en ATP avec augmentation de DNA et augmentation de la mitose.
Il y a parallèlement une action anti œdème car le rayonnement laser permet la libération de l’acide nitrique (monoxyde d’azote) au niveau des cellules endothéliales des vaisseaux sanguins avec dilatation des parois des vaisseaux sanguins (augmentation de l’apport des cellules sanguines) et des parois lymphatiques (augmentation de l’évacuation des protéines), et une action anti douleur en entravant sa transmission au niveau des fibres nerveuses par stimulation de précurseurs opiodes qui provoquent des vésicules axonales transitoires, ce qui explique la très bonne acceptation de ce protocole par le patient.
Nous avons aussi, dans les séances de contrôle, utilisés les effets bio stimulants seuls par irradiation à distance (1 à 1.5 cm) à basse fluence à l’aide d’une lentille défocalisante pendant 30 à 40 secondes par face. Il n’y a alors pas de ressenti de la chaleur en raison de la répartition de l’énergie sur les surfaces cibles (décrit en 1970 par le professeur A. Benedicenti, Gènes). Cela entraine un accroissement avec prolifération cellulaire (macrophages, lymphocytes, cellules endothéliales, kératinocytes…) et une libération naturelle des facteurs de croissance sanguins, une oxygénation ainsi qu’une respiration cellulaire entrainant une synthèse de l’adénosine triphosphate ATP. La conséquence sur les tissus gingivaux étant la transformation des fibroblastes en myofibroblastes et la synthèse du collagène. Cela se traduit cliniquement par une effet antalgique anti inflammatoire cicatrisant et reconstructeur tissulaire.
Discussion et analyse de la littérature
Lors du 10th European Consensus Conférence (2015, Cologne), le but du traitement est actuellement de réduire les signes et symptômes de l’inflammation et d’arrêter sa progression
Un grand nombre d’études (27) prouvent aujourd’hui que l’utilisation d’un laser diode utilisé avec une PDT est efficace pour combattre la population microbienne de la poche péri-implantaire. Les dernières études de Caccianiga G, Rey G. (12,13,2) prouvent l’efficacité supérieure du peroxyde d’azote comme photosensibilisateur par sa transparence sur les autres produits habituellement utilisés dans les PDT et qui absorbent plus les rayonnements ou qui peuvent être toxiques. Dans son étude, il teste l’utilisation de glycérol associé afin de maintenir le sensibilisateur sur les tissus cibles ce qui semble encore augmenter l’efficacité. De plus, il prouve la plus grande efficacité des lasers diode haute fréquences qui permettent de délivrer de plus fortes doses de photons actifs sur l‘oxygène.
L’étude réalisée et parue dans le LS 80 de nov. 2018 des docteurs Rey, Bonnin et Bland (44) valide la technique de PDT sans colorant avec les lasers diodes à haute fréquence en 980nm et 470nm associé ou non à un 980nm et plusieurs passages de 10 s, sur l’élimination de streptococcus aureus in vitro et in vivo .Cette bactérie ayant une affinité particulière avec le titane.
L’utilisation du laser Erbium peut être validée par de nombreux articles et études.
Une évaluation in vitro (22) de différents lasers sur des disques de titane contaminés a prouvé l’efficacité de l’Er : YAG à décontaminer ces surfaces même avec de faibles énergies (100% des bactéries éliminées à 90mJ à 10Hz pendant 10 secondes en mode super pulsé (300ms par pulse)), ainsi que celle du CO2 et de la diode 808nm à 1W en continu pendant 10 secondes avec un pièce à main R -14_B pour une faible fluence.
Une méta analyse de 2014 / 2015 (19), , rappelle l’efficacité bactéricide du laser Er YAG ou Er,Cr YSGG, les paramètres afin d’ éviter les dommages sur le titane et surtout étudie les résultats dans le cadre d’une alternative au traitement conventionnel par débridement. Il apparait nécessaire pour atteindre la lésion (absorption sur 2 microns) d’utiliser un cône fibré, avec une puissance inférieure à 300mJ /10Hz sur une surface SLA et inférieure à 500mJ/10Hz pour les surfaces polies (24) pour éviter des dommages sur la surface implantaire (17 ; 16) et ne pas influencer le taux d’attachement des ostéoblastes ; bien entendu, voir même de favoriser cet attachement cellulaire (23).
Une autre revue d’études entre 2002 et 2014 /2015 (14) conclu, par un effet bactéricide effectif du laser diode 980nm sans changement de la surface implantaire, que le laser Er,Cr:YSGG permet d’obtenir une bonne régénération osseuse et l’Er:YAG un fort effet bactéricide sur les bactéries de la parodontopathie à faible niveau d’ énergie ; cependant cette revue montre également que ces résultats prometteurs nécessitent des essais randomisés. Dans une étude in vitro de 2017 de Sigrun Eick and Col. (23) le laser Er:Yag seul est moins efficace que Curetage +PDT mais plus que Curetage seul ou PDT, mais ici PDT avec sensibilisateur bleu, phénothiazine chlorite seul, et conclu que sur la surface implantaire titane son utilisation présente un large avantage sur les autres modalités de débridement avec une désintégration du biofilm compte tenu des spires.
De nouvelles études objectivent la stimulation de facteurs de croissance d’origine plaquettaire lors de la préparation de sites d’ostéotomie sur des rats, l’amélioration de la cicatrisation par activation de la prolifération ostéoblastique. (40) Une équipe iranienne (18) a étudié l’efficacité de l’Erbium sur la stimulation des fibroblastes gingivaux in vitro et montre que sur une culture après 24 et 48h il y a une augmentation du nombre de fibroblastes. Ceci peut donc activer la cicatrisation.
Une étude de 2014 sur différentes longueurs d’onde utilisées dans la seconde étape de chirurgie implantaire prouve qu’il n’existe pas d’augmentation de température sur les tissus environnants mais ne fournissent aucun élément sur les paramètres praticiens (35).
Les effets de bio stimulation sur la cicatrisation sont argumentés par une étude randomisée (37) sur des ulcérations buccales en concluant que l’énergie de 4J/cm2 est plus efficace qu’une énergie de 20J/cm2 et visualisent un pourcentage de cicatrisation plus important qu’avec un groupe témoin ainsi qu’un degré de ré épithélialisation et de dépôt de collagène plus important. Le résultat est le plus probant après 5 jours d’irradiation. Une étude de publications sur les impacts cellulaires des Low Level Laser rapporte les mécanismes influents sur les mécanismes de l’inflammation, de la réparation cellulaire et de la douleur. (38)
Conclusion
L’association de ces deux lasers dans ce type de traitement non chirurgical permet l’optimisation de la désinfection de l’implant et de son environnement, os et tissus mous, contaminé par les bactéries et leurs toxines en diminuant efficacement les risques thermiques qui pourraient altérer le titane ou l’environnement implantaire. Ils se potentialisent et permettent d’amener sur place les facteurs de croissance sanguins par vasodilatation et coagulation et donc d’améliorer la cicatrisation et la régénération cellulaire des différents tissus concernés. Une parfaite connaissance de ces lasers permet d’optimiser leur efficacité.
De nombreuses études de cas (40,42) rapportent des résultats équivalents, mais nous sommes dans l’attente d’études de niveau 1 et 2 afin de pouvoir valider définitivement ces traitements et tendre à l’émergence d’un consensus sur l’utilité des lasers dans notre domaine d’activité.
Bien entendu, le traitement de la péri-implantite passe par la surveillance et la mise en place de protocoles d’hygiène absolus comme dans les cas des parodontopathies. Il nous faut insister aussi sur la prévention en préparant la cavité buccale à la présence d’un implant, en optimisant les techniques de pose, en optimisant les prothèses et la gestion de leur entretien par un enseignement à l’hygiène et une maintenance adaptée à l’état général et aux antécédents de nos patients afin de détecter les premiers signes infectieux et inflammatoires par la référence du saignement au sondage, et les clichés radio long cône .
Cas réalisé et présenté par l’auteur avec l’assistance des Drs David Dilouya et Jean Michel Stroumza lors des séances pratiques du D.U de Chirurgie Dentaire Laser Assisté présidé par le Dr Missika.
Bibliographie
(1) Péri-implantites Giovannoli JL, Renvert Stephan. Editions Quintessences international
(2) Les lasers et la chirurgie dentaire. Innovations et stratégies cliniques. Rey G, Missika P, Bufflier P, Caccianiga GL, Costesseque M, Fromental R, Sebban A, Stroumza J M .JPIO Editions CDP
(3) La gencive péri-implantaire Bert M, AOS 2013;264:4-8
(4) Laser et implantologie : simplicité et efficacité, Rey G, Missika M, ID 2010,16:21-29
(5) Microbial complexes in sub gingival plaque, Socransky SS, Haffajee AD,Cugini MA,Smith C,Kent RL., J Clin Periodontol 1998;25:134-44
(6) The bactérie etiology of destructive périodontll disease: currents concepts., Socransky SS , J Periodontol 1992;63:322-31
(7) Intraindividual variation in core microbiota in peri-implantitis and periodontitis, Noriko Maruyama,1 Fumito Maruyama,a,2 Yasuo Takeuchi,b,1 Chihiro Aikawa,2 Yuichi Izumi,1 and Ichiro Nakagawa, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4194447/citedby
(8) Clinical, Radiographic and Microbiological Evaluation of High Level Laser Therapy, a New Photodynamic Therapy Protocol, in Peri-Implantitis Treatment; a Pilot Experience, Gianluigi Caccianiga, Gerard Rey, Marco Baldoni, Alessio Paiusco, Biomed Res Int. 2016; 2016: 6321906. Published online 2016 Jun 9. doi: 10.1155/2016/6321906
(9) Clinical, microbiological, and immunological aspects of healthy versus peri-implantitis tissue in full arch reconstruction patients: a prospective cross-sectional study, Javier Ata-ali, Antonio Juan Flichy-Fernandez, Teresa Alegre-domingo, Fadi Ata-Ali,Jose Palacio, and Miguel Penarrocha-diago, BMC Oral Health 2015;15;43 toi: 10.1186/s12903-015-0031-9
(10) Soft tissue response to plaque formation at different implant systems, a comparative study in the dog. Abrahamson J, Berghendh T, Lindhe J, Clin Oral Implants Res 1988 :9 :73-79
(11) Comparative biology of chronic and aggressive periodontitis vs peri-implantitis, Lisa J, Heitz- Mayfielf Niklaus P,Lang, Periodontology 2000, Vol 53, 2010, 167-181
(12) A Preliminary In Vitro Study on the Efficacy of High-Power Photodynamic Therapy (HLLT): Comparison between Pulsed Diode Lasers and Superpulsed Diode Lasers and Impact of Hydrogen Peroxide with Controlled Stabilization, Gianluigi Caccianiga, Marco Baldoni, Carlo Angelo Ghisalberti, Alessio Paiusco, Biomed Res Int. 2016; 2016: 1386158. Published online 2016 Aug 18. doi: 10.1155/2016/1386158
(13) Clinical, Radiographic and Microbiological Evaluation of High Level Laser Therapy, a New Photodynamic Therapy Protocol, in Peri-Implantitis Treatment; a Pilot Experience, Gianluigi Caccianiga, Gerard Rey, Marco Baldoni, Alessio Paiusco, Biomed Res Int. 2016; 2016: 6321906. Published online 2016 Jun 9. doi: 10.1155/2016/6321906
(14) Comparison of the efficacy of different types of lasers for the treatment of péri-implantitis: a systematic review., Natto ZS, Aladmawy M, Levi PA Jr,Wang HL., Int J Oral Maxillofac Implants 2015 MAR-APR;30(2):338-45. Toi: 10.11607/jomi.3846.
(15) Laser Treatment of peri-implantitis: A Litterature Review, Sajjad Ashnagar, Hessam Nowzari, Hanieh Nokhbatolfoghahaei, Behnoush Yaghoub Zadeh, Nasim Chiniforush, Nastaran Choukhachi Zadeh, J Lasers Med Sci. 2014 Autumn; 5(4): 153–162., PMCID: PMC4281989
(16) Effects of laser irradiation on machined and anodized titanium disks., Park JH, Her SJ, Koak JY, Kim SK, Han CH, Lee JH., Int J Oral Maxillofac Implants 2012 MAR-APR;27(2):265-72
(17) Influence of an Er:YAG laser on the surface structure of titanium implants.Schwarz F, Rothamel D, Becker J, Schweiz Monatsschr Zahnmed. 2003; 113(6):660-71.
(18) Treatment Alternatives to Negotiate Peri-Implantitis, Eli E. Machtei, Adv Med. 2014; 2014: 487903. Published online 2014 Jun 15. doi: 10.1155/2014/487903, PMCID: PMC4590969
(19) The effect of Er:Yag on the treatment of péri-implantitis: a meta-analysis of randomized controlled trials, Mingdong Yan, Miaomiao Liu, Min Wang, Fengying Yin, Haibin Xia, Lasers Med Sci (2015) «30:1843-1853
(20) Ten lectures on basic science of laser phototherapy, Karu T., Photochemistry and photobiology,2007,83:1539-1540 Published by prima books AB, Grangesberg, Sweden,2017
(21) A Comparative Study of the Effectiveness of immediate Versus Delayed Photobiomodulation Therapy in reducing the severity of postoperative Inflammatory Complications, Abdel-Alim Hala M, Abdel-dayem Hassan, Mustapha Zeinab A, Bouyami Amr, Jan Ahmed, and Jadu Fatima., Photomedecine and Laser Surgery. September 2015, 33(9):447-451. Doi:10.1089/pho.2015.3923.
(22 )Comparative Evaluation of Antimicrobial Effects of Er:YAG, Diode, and CO2 Lasers on titanium discs: An experimental Study, J Oral Maxillofac Sur 70:1064-1069,2012
(23) In Vitro-Activity of Er:YAG Laser in Comparison with other treatment Modalities on Biofim Ablation from Implant and Tooth Surfaces, Sigrun Eick, Ivan Meier, Forian Spoerlé, Philip Bender, Akira Aoki, Yuichi Izumi, Giovanni E. Salvi, Anton Sculean Publisched january 26,2017 . doe.org/10.1371/journal.pone.0171086
(24) Surface alterations of polished and sandblasted and acid-etched titanium implants after Er:YAG, carbon dioxide, and diode laser irradiation., Stubinger S, Etter C, Miskiewicz m, Homann F, Saldamli B, Wieland M, Sader R, Int J Oral Maxillofac Implants 2010 Jan-Fev;25(1):104-11
(25) Systematic Review and Méta-Analysis of the Effect of Various Laser Wavelengths in the Treatment of Peri-implantitis, Géorgios A. Kotsakis, Ioannis Konstantinidis,Ioannis K. Karoussis, Xiaoye Ma, and Haitao Chu, J Periodontal. Sept2014 (doi: 10.1902/jop.2014.130610)
(26) Microbiologic results after non-surgical erbium-doped:yttrium, aluminum, and garnet laser or air-abrasive treatment of peri-implantitis: a randomized clinical trial., Persson GR, Roos-Jansåker AM, Lindahl C, Renvert S, J Periodontol. 2011 Sep; 82(9):1267-78.
(27) Management of severe periodontal abscesses using Laser/light-Emitting Diode (LED) Procedure Adjunctive to scaling and root planing. A Case-Series Study, Gianneli M,Materassi F, Lorenzini L,Bani D, Clinical advances in periodontics, Vol.0,N°.0,Pages 1-10 (doi:10.1902/cap.2017.160090)
(28) Implacations of salivary protein binding to commensal and pathogenic bacteria, J Oral Biosci 2013 Nov 1:55(4): 169-174 toi: 10.1016/job.2013.06.004
(29) Are peri-implantitis lesions different from periodontitis lesions?, Berglundh T, Zitmamann Nu,Donati M, J Clin Periodontol. 2011 Mar;38 Suppl 11:188-202
(30) Microbiology and antimicrobial therapy of peri-implantitis , Mombelli A., Periodontol 2000 2002;28:177-89
(31) Efficacy of alternative or adjunctive measures to conventional treatment of peri-implant mucositis and peri-implantitis: a systematic review and meta-analysis, Frank Schwarz, Andrea Schmucker, Jürgen Becker, Int J Implant Dent. 2015 Dec; 1(1): 22. Published online 2015 Aug 13. doi: 10.1186/s40729-015-0023-1, PMCID: PMC5005629
(32) Mechanical, chemical and laser treatment of the implant surface in the presence of marginal bone loss around implants. Meyle J.Eur J Oral Implantol. 2012;5 Suppl:S71-81
(33) Clinical, Radiographic and Microbiological Evaluation of High Level Laser Therapy, a New Photodynamic Therapy Protocol, in Peri-Implantitis Treatment; a Pilot Experience, Gianluigi Caccianiga, Gerard Rey, Marco Baldoni, Alessio Paiusco, Biomed Res Int. 2016; 2016: 6321906. Published online 2016 Jun 9. doi: 10.1155/2016/632190
(34) Surgical Regenerative Treatments for Peri-Implantitis: Meta-analysis of Recent Findings in a Systematic Literature Review, Povilas Daugela, Marco Cicciù, Nikola Saulacic, J Oral Maxillofac Res. 2016 Jul-Sep; 7(3): e15. Published online 2016 Sep 9. doi: 10.5037/jomr.2016.7315
(35) Different Laser wavelengths comparison in the second- stage implant surgery: an ex vivo study., Formaini C,Mergo E,Vescovi P, Bonamini M,Antonietti W, Leoci L, Lagori G, Meleti M, Lasers Med Sci. 2014 Jul 3
(36) Treatment of peri-implantitis around TiUnite-surface implants using Er:YAG laser microexplosions. Yamamoto A, Tanabe T, Int J Periodontics Restorative Dent. 2013 Jan-Feb; 33(1):21-30.
(37) Influence of different energy densities of laser phototherapy on oral wound healing, Vivian Petersen Wagner, Luise Meurer, Marco Antonio Trevizani Martins, Chris Krebs Danilevicz, A S Magnusson, MM Marques, M S A Filho, C H Squarize, M Domingues Martins. Journal of Biomedical Optics 18(12), 128002 5 december 2013)
(38) The role of Low Level Laser in Periodontal surgeries, Farhab Sobouti, Maziar Khatami, Mohaddase Heydari, Maryam Barati. Journal of Lasers in Medical Sciences Vol 6 Number 2 spring 2015
(39)The Frequency of Peri-Implant Diseases: A Systematic Review and Meta-Analysis Momen A. Atieh, Nabeel H.M. Alsabeeha, Clovis Mariano Faggion Jr., and Warwick J. Duncan, Journal of Periodontology, November 2013, Vol. 84, No. 11 , Pages 1586-1598 (https://doi.org/10.1902/jop.2012.120592)
(40) A concept of laser assisted treatment of periimplantitis, Dr Gérald Mettraux, Laser 1/2011
(41) GR;Périodontitis as a potential risk factor for péri-implantitis., J;Clin Periodontol 2009;36(suppl10);9-14
(42) Traitement laser assisté des péri-implantites , Dr Amandine Para, Clinical implantology 16 Juin 2015 dental tribune
