Parodontologie et lasers # 1
Dossier Parodontologies et bonnes pratiques, 2è volet
AoNews #41 - Mars 2021
Introduction
La parodontite chronique atteint 20% à 30% de la population adulte (1). Les études épidémiologiques associent aujourd’hui la maladie parodontale aux maladies cardiaques, au diabète, aux accidents vasculaires cérébraux, aux naissances prématurées (2,3) et aux infections des voies respiratoires (4,5). Il n’existe pas, néanmoins à ce jour, de facteur causal mis en évidence. Cependant certaines études montrent une corrélation statistique entre la maladie parodontale et des indicateurs métaboliques, tels l’indice de masse corporelle ou l’hémoglobine glyquée.
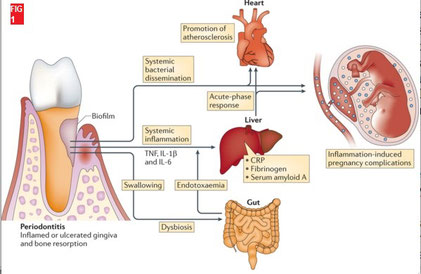
De plus, des mécanismes étiopathogéniques impliquant les bactéries pathogènes parodontales dans la genèse de ces pathologies, sont autant d’arguments en faveur d’une association mettant en avant l’importance de la prise en charge parodontale en santé publique. fig 1
Rappelons les mécanismes de la maladie parodontale.
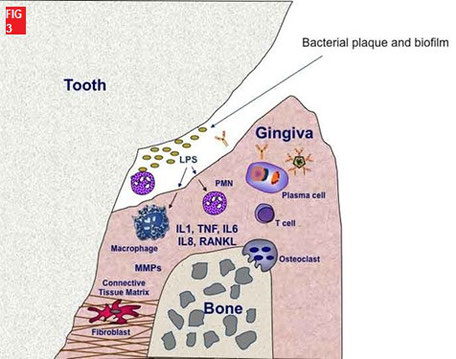
Une gingivite chronique évolue le plus souvent vers une parodontite sévère à modérée suivant une classification impliquant l’âge, la quantité et la nature des alvéolyses. Elle se caractérise par l'organisation et l'activité du biofilm. Le biofilm, une communauté complexe de micro-organismes, est organisée et adaptable (6). Il dispose d’une résistance à de nombreux facteurs de l’hôte, en particulier, les macrophages, le système immunitaire et aux antibiotiques (7) permettant ainsi,

aux bactéries de pénétrer l'épithélium et le conjonctif sous-jacent (8,9). L’hôte libère alors de nombreuses substances dont les cytokines, les prostaglandines, et
des enzymes protéolytiques (collagénase, gélatinase, élastase) entrainant une destruction et un remaniement tissulaire (3,10). Fig
2
Meyle J , Chapple I .Aspects moléculaires de la pathogenèse de la parodontite.; 69 (1): 7-17. doi: 10.1111 / prd.12104. Periodontol 2000. Octobre 2015
En Parodontologie, le laser est il un acteur intéressant ?
La Parodontologie Laser assistée est un sujet très discuté à ce jour, voire polémique.
En préambule, Il faut rappeler qu’un laser se définit avant tout par sa longueur d’onde et que sous le terme « laser » se cachent un grand nombre de longueurs d’ondes différentes aux caractéristiques physiques très différentes. Les effets lasers étant la conséquence directe des caractéristiques physiques du faisceau, il est aisé de comprendre que l’on ne peut pas les regrouper sous un même vocable. Il conviendra de définir les effets d’un « laser d’une longueur d’onde donnée» par rapport à d’autres lasers de longueurs d’onde différentes. La contreverse portant sur l’intérêt de l’usage de cette technologie en parodontologie est soumise à quelques raisons valides, et d’autres discutables voire probablement invalides.
L’argumentation repose principalement sur :
- le coût des lasers à l’efficacité démontrée, souvent très onéreux, donc peu répandus, par rapport à l’utilisation de lasers moins onéreux, mais plus répandus, à cause de leur prix d’achat plus raisonnable, mais à l’efficacité moins spécifique ;
- ou sur l’absence de preuve formelle du bénéfice thérapeutique.
Le jugement est trop souvent hâtif et partial. Pour mieux comprendre la place que cette technique occupe aujourd’hui il convient de suivre l’évolution de la discipline parodontale.
Dans les années 70 la parodontie était principalement chirurgicale dite par soustraction. Il était recommandé de « mettre à plat » les poches parodontales, le processus cicatriciel se chargeant de la ré-attache. Le résultat cosmétique était désastreux et les résultats cliniques n’étaient pas nécessairement pérennes.
Plus tard dans les années 80, apparaissait une chirurgie parodontale dite par addition, reposant sur des méthodes chirurgicales sophistiquées, de sutures, de déplacements tissulaires, de comblements, de greffes.
Puis est apparu le concept de parodontie médicale (7). C’est dans ce cadre précis que la technologie laser trouve sa place, tant en désinfection qu’en microchirurgie parodontale.
Le concept de parodontologie médicale repose sur la notion de biofilm bactérien, de réponse immunitaire mais également sur des facteurs de risques tels que hérédité, tabagisme, alimentation, hygiène bucco-dentaire, etc.
Dans notre activité, le problème posé consiste à :
- rechercher les origines des parodontopathies,
- gérer leurs causes,
- associer différentes méthodes thérapeutiques,
- avoir des réponses tissulaires rapides.
Le facteur d’efficacité dans le temps est introduit. La rapidité dans l’obtention, de résultats efficaces probants, encourageants et sécurisants est le facteur fondamental pour que le patient adhère aux contraintes thérapeutiques proposées.
Grâce aux lasers : « agir vite, profondément, efficacement ».
Ne pas laisser la maladie parodontale s’installer, arrêter la destruction du système d’attache, stopper l’accumulation des PMN en réponse à la stimulation bactérienne iatrogène, bloquer les altérations du tissu conjonctif, décoloniser l’espace jusqu’au contact du tissu osseux et même dans l’os, pour la satisfaction du praticien.
Sur cet aspect, personne ne peut démentir l’efficacité des Lasers.
Les lasers « chauds ou hard » et les « softs lasers » par la Photo Dynamic Therapy (PDT ) ont été très largement étudiés et ont démontré leur efficacité dans le traitement des parodontopathies et dans les traitements des péri-implantites . On peut citer de très nombreuses publications (8, 9, 10, 11, 12, 13, 14).
Améliorer le plus vite possible le déséquilibre de l’écosystème parodontal, les aspects cliniques et les phénomènes plus ou moins douloureux ressentis par le patient : saignement, mobilité des dents, hypersensibilité dentinaire, suppuration et abcès parodontaux,
Dans un système de santé « idéal » la gestion de ces pathologies devrait passer par la prévention, mais pour agir vite, la « technologie laser », démontrée par de très nombreuses publications, présente de belles perspectives qui restent, probablement, à valider par des études fondamentales incontestables (15 ) pour une intégration officielle dans l’arsenal thérapeutique dont nous disposons.
Bezzina-Moulierac ME, Rocca JP Laser et parodontie, in Parodontie médicale. Innovations cliniques, 2nd Ed, Ed CdP, 2010, 431-447).
Pourquoi utiliser les lasers en parodontologie ?
Les lasers permettent de réaliser de façon plus efficace et plus aisée :
- le traitement parodontal dit « non chirurgical » ;
- ou en complément d’un « traitement chirurgical » par : l’élimination du biofilm radiculaire (surtout quand la topographie radiculaire et osseuse sont complexes, l’élimination des bactéries intracellulaires de la poche, l’’obtention d’une surface cémentaire compatible avec une réattache ou une régénération tissulaire, une biomodulation (dont l’action diminue l’inflammation et accélère la cicatrisation parodontale).
En effet, les lasers grâce à leur action contrôlée et réitérative, à leurs propriétés antibactériennes et anti-inflammatoires, offrent une alternative thérapeutique complémentaire, au traitement SRP des parodontopathies.
Le choix de l’utilisation du rayonnement laser en parodontologie, s’effectue selon l’indication clinique et par une validation de l’outil associé :
- un choix de la longueur d’onde, donc choix du type de laser,
- un choix du dispositif d’émission : bras articulé ou fibre, transmission par miroir ou par tip. Fig 3 / Fig
4

Rarement une technologie a suscité autant, d’études, d’analyses et d’investigations dans nos domaines thérapeutiques.
En effet, si la longueur d’onde est un facteur primordial dans l’efficacité du laser en parodontologie, il en va de même pour les conditions de mise en œuvre : la puissance, la surface impactée, la durée des tirs, le temps de relaxation, de repos, donc de récupération tissulaire, l’association longueur d’onde / liquide d’infiltration, etc….
Remarque : il n’y a pas, à ma connaissance, d’études montrant la différence d’élévation de températures de la pulpe en fonction, de la forme de la fraise utilisée, de sa granulométrie, de son usure, de sa vitesse de rotation, de la pression exercée, ou encore du débit de spray …
Choix d’une longueur d’onde en parodontologie ?
Il convient de se rappeler que tous les lasers qui peuvent être utilisés ne produisent pas les mêmes effets lesquels selon la longueur d’onde.
Les Lasers doivent revendiquer leurs atouts, que sont :
- le pouvoir bactéricide,
- le contrôle de l’hémostase et de la douleur,
- souvent l’absence d’anesthésie,
- l’ablation sélective et controlée.
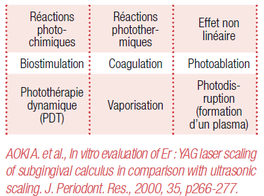
Les traitements adjuvants « lasers-assistés » constituent des perspectives prometteuses en termes d’efficacité, d’amélioration des suites post-opératoires et d’accélération de la cicatrisation.
Interactions lasers tissus
Tous les lasers qui peuvent être utilisés en Parodontologie ne produisent pas les mêmes effets, selon la longueur d’onde, mais on peut définir trois processus majeurs d’interaction tissu/laser.
Lasers à effet thermique
La lumière convertie en chaleur est à l’origine d’une dénaturation ou d’une destruction du tissu cible. Le niveau de l’élévation de température dans le tissu est lié, à sa composition, à sa couleur, ainsi qu’au pouvoir de pénétration de la longueur d’onde utilisée. Ces Lasers sont principalement, les lasers KTP, Diodes, Nd-YAG, Nd-YAP, CO2. Le moins absorbé en profondeur est le laser CO2, mais il ne peut être fibré ce qui le rend inutilisable en profondeur de poche en particulier dans les situations en aveugle. Il sera donc utilisé pour les chirurgies à ciel ouvert. Les plus absorbés sont les lasers Nd-YAG et Nd-YAP ce qui implique que leur utilisation soit parfaitement contrôlée.
(Vescovi P, Merigo E, Fornaini C, Rocca JP, Nammour S ; Thermal increase in the oral mucosa and in the jawbone during Nd:YAG laser applications. Ex vivo study. Med Oral Patol Oral Cir Bucal. 2012 Jul 1;17(4):697-704).
Vescovi P, Corcione L, Meleti M, Merigo E, Fornaini C, Manfredi M, Bonanini M, Govoni P, Rocca JP, Nammour S ; Nd:YAG laser versus traditional scalpel. A preliminary histological analysis of specimens from the human oral mucosa. Med Oral Patol Oral Cir Bucal. 2012 Jul 1;17(4):697-704).)
Cette absorption dépend aussi, de l’énergie utilisée par unité de surface (Fluence) ou de la puissance (Densité de Puissance ou « Power Density ») ainsi que du temps d’exposition. Avec ces lasers il convient d’utiliser des énergies relativement basses (1 à 3W) et des déplacements rapides en particulier en profondeur de poche. Dans l’hypothèse où un lambeau serait élevé et où on utiliserait un Laser CO2, les traces de carbonisation susceptibles d’être laissées sur les surfaces traitées pourraient gêner les processus de cicatrisation.
Les autres lasers cités sont bien absorbés dans les couleurs sombres.
Les conséquences des effets thermiques non maitrisés sont :
- l’hyperthermie, qui entraine une mort cellulaire retardée par atténuation ou atteinte des processus enzymatiques ;
- la coagulation, qui correspond à une nécrose irréversible par dessiccation suivie d’une rétraction tissulaire par dénaturation des protéines et du collagène ;
- Les tissus irradiés vont dans un deuxième temps être éliminés par détersion puis cicatriser s’ils n’ont pas été détruits totalement.
- la volatilisation sur les berges de la zone irradiée où on observe une nécrose de coagulation, car la transition thermique entre zone volatilisée et zone saine de fait graduellement.
Ces lasers thermiques sont utiles en chirurgie et donc en chirurgie parodontale d’exérèse et doivent être manipulés avec de très faibles énergies en décontamination des poches parodontales.
Lasers à effets mécaniques
Ces effets peuvent être à l’origine de la création d’un plasma, d’une vaporisation explosive ou d’une cavitation (onde de choc). C’est l’expansion de cette onde de choc qui produit l’effet destructif. Ces lasers sont utilisés principalement en ophtalmologie.
Lasers à effet photoablatif.
C’est le cas du laser Er-YAG (2940nm). Très absorbé dans l’eau et l’hydroxyapatite (comme le CO2), il produit une vaporisation immédiate et superficielle du tissu irradié. Sans effet thermique, plus précisément en absence de diffusion de l’effet thermique, une très brève durée de tir (microseconde) le rend particulièrement très efficace. Comme il existe de l’eau dans tous les tissus parodontaux et dans les bactéries ou encore dans les dépôts tartriques, l’Er-YAG une longueur d’onde de choix en Parodontologie.
Lasers à effet photodynamique
Cette méthode de décontamination en endodontie et parodontie consiste à marquer un tissu pathologique à l’aide d’un photosensibilisant puis à l’irradier avec un laser dont la longueur d’onde est généralement située dans le visible (rouge). Survient alors une réaction phototoxique limitée, en durée et en volume, particulièrement efficace efficace.
Choisir un laser en parodontie
Action sur les tissus mous.
La technique laser est faite pour remplacer la lame froide, le bistouri électrique, le bistouri à résonance magnétique.
Vescovi P, Manfredi M, Merigo E, Fornaini C, Rocca JP, Nammour S, Bonanini M.Br Quantic molecular resonance scalpel and its potential applications in oral surgery. J Oral Maxillofac Surg. 2008 Jul; 46(5):355-7.
Pour les tissus mous, grâce, à leur pouvoir d’ablation et à leur effet hémostatique, les lasers CO2 (10 600 nm), Nd/YAG (1 064 nm), les Diodes 980nm, sont utilisables, en alternative à la lame froide, pour les interventions de chirurgie parodontale et buccale (American Academy of Periodontology, 2002).
Dans le cas précis de la chirurgie des tissus mous, le laser à gaz carbonique (CO2) peut rendre de grands services lorsqu’un patient présente de sévères troubles de la crase sanguine.
Il faudra toutefois prendre la précaution de protéger les tissus durs de la dent, en particulier lors de gingivectomies, frenectomies, car cette longueur d’onde est absorbée dans l’hydroxyapatit. L’effet thermique permet une chirurgie exsangue et le champ opératoire est parfaitement visible tout au long de l’intervention. Le problème éventuel de la carbonisation superficielle est résolu par badigeonnage à l’aide d’un coton tige humidifié ou raclage superficiel. Ce problème n’existe plus avec le laser CO2 9800nm d’utilisation à ce jour encore confidentielle. La longueur d'onde du CO2 est très absorbée par l'eau et l'hydroxyapatite. Sa profondeur de pénétration n’est que de 0,5 mm.
Ainsi le fluide sulculaire et les membranes cellulaires sont vaporisés sous l’effet photothermique du rayonnement. Celles adjacentes sont inactivées par dessiccation. (17, 18) Les plus récents lasers CO2 micropulsés, offrent un très bon contrôle de l'énergie, ce qui rend leur application sûre et efficace au sein de la poche parodontale. Ces lasers fournissent une puissance de crête importante, des durées d'impulsions ultracourtes, plus de temps de relaxation thermique pour les tissus cibles. Il y a moins d’effets délétères adjacents, donc moins de suites post opératoires.
Les lasers Nd-YAG et Nd-YAP tous deux thermiques sont, efficaces en coupe, hémostatiques, mais doivent être manipulés avec des déplacements rapides et répétés compte tenu de leur absorption en profondeur (5 à 7mm) dans les tissus.
Le Nd/YAG laser pulsé, émet dans des puissances de crête élevées (on time) mais il permet une relaxation thermique tissulaire pendant le temps d'arrêt d’émission laser (off time)
Les lasers Diodes, bien absorbés dans l’hémoglobine et autres pigments sombres, sont faciles à utiliser car un peu moins absorbés en profondeur que le Nd-YAG. Leur évolution récente (couplage de différentes longueurs d’ondes) les rend de plus en plus intéressants car efficace en coupe et hémostatiques (couplage 930nm et 1064nm). Leur faible coût explique aussi leur succès. Les longueurs d’onde des lasers Diodes de 810-980 nm, possèdent une bonne pénétration tissulaire. Ils sont absorbés dans l’hémoglobine et la mélanine, ils constituent de bons lasers pour la chirurgie parodontale. Les chromophores des composés organiques de la poche parodontale absorbent les radiations émises ce qui rend ces longueurs d’ondes efficaces dans le débridement sulculaire.
Un diode 980nm, mieux absorbé dans l’eau, n’a pas montré de supériorité pour le débridement par rapport aux autres longueurs d’onde des lasers diodes. (14, 31, 32) Les lasers Diodes sont utilisés en « mode continu », avec des énergies faibles et des temps d'application longs, ou en « mode pulsé » (énergie constante interrompue par des intervalles constants de repos, donc de refroidissement), avec des énergies plus élevées et des temps d'application courts.
Ces nouveaux lasers Diodes 980 nm diminuent la chaleur accumulée et les risques de dommages thermiques tissulaires adjacents.
En parodontologie, les lasers Erbium (Er-YAG et Er, Cr-YSGG) sont de toutes évidence les plus efficaces, les moins absorbés en profondeur, les plus surs et faciles à utiliser. Les indications ne cessent de s’élargir et les appareillages sont de plus en plus simples à utiliser.
Les lasers Erbium pulsés, Er/YAG (2940 nm) et Er, Cr/YSGG (2780nm), sont les lasers les plus absorbés dans l’eau et l’Hydroxyapatite (HA). Ils possèdent donc une très faible pénétration tissulaire. Ils permettent toutes les chirurgies des tissus mous avec une hémostase moins efficace que celle des lasers Diodes et lasers CO2. Ils sont d’un grand confort d’utilisation. Ils permettent une élimination significative des pathogènes, dont les bactéries Pg et Aa, de la poche parodontale, un maintien des résultats à long terme (12, 19, 34), une cicatrisation plus rapide et plus esthétique des tissus. (12, 33)
Enfin le laser KTP (532nm), second harmonique du laser Nd-YAG, parfaitement adapté à la gestion des hémangiomes l’est aussi dans la chirurgie des tissus mous.
Fornaini C, Rocca JP, Merigo E, Meleti M, Manfredi M, Nammour S, Vescovi P. Low energy KTP laser in oral soft tissue surgery: A 52 patients clinical study..Med Oral Patol Oral Cir Bucal. 2012 Mar 1;17(2) 287-91).
Le laser KTP (532 nm), (Nammour et al., 2005) a des effets et des indications à rapprocher de ceux du laser Nd/YAG.
Action sur les tissus durs
Tissu osseux
On le sait, l’élévation thermique du tissu cible due à l’irradiation par les lasers dépend de la longueur d’onde utilisée. Dans le cas précis l’utilisation des lasers KTP, Diodes, Nd-YAG, Nd-YAP et CO2 sont contre-indiqués (effet photothermique). On doit se rappeler qu’au-delà de 47°, l’os commence à se résorber et qu’il se nécrose à partir de 60°. Dans les chirurgies parodontales à ciel ouvert, les lasers CO2 (10 600 nm), Diodes (660 à 980 nm) et laser Nd/YAG (1 064 nm) et Nd/YAP (1341 nm) sont à utiliser avec précaution, car leurs effets d’élévation thermique ou de carbonisation sur les surfaces radiculaires et sur l’os peuvent être délétères. (36)
Il ressort de cette observation que seuls les lasers Er :YAG et Er,Cr :YSGG sont utilisables sur le tissu osseux sans risque iatrogène. Ils présentent des longueurs d’onde compatibles avec l’application sur les tissus osseux, de plus ces lasers sont couplés avec des sprays d’air et d’eau réglables en termes de ratio.
L’ostéotomie avec le laser Er :YAG semble comparable à l’ostéotomie à la fraise rotative (25,26) alors que le laser CO2 produit des dommages tissulaires. L’ostéotomie sur tissu animal avec le laser Er, Cr :YSGG sous spray entraîne une cicatrisation totale du tissu osseux à 56 jours (19,35). Le laser Er YAG possède une efficacité identique aux techniques classiques lors de plastie osseuse, mais aucune étude ne démontre un bénéfice supérieur à son utilisation, par rapport aux instruments rotatifs classiques.
Dépôts tartriques
L’élimination des dépôts tartriques avec le laser résulte de la vaporisation de l’eau contenue dans les calculs tartriques, avec une augmentation de pression qui produit des micro explosions de ces calculs.
La longueur d’onde utilisée doit coïncider avec le pic d’absorption de l’eau pour éviter les dommages thermiques sur les tissus périphériques cément et pulpe.
Ainsi de nombreuses études in vitro et in vivo montrent que le laser Nd/Yag et le laser CO2 génèrent des zones de carbonisation ou de fusion de la surface cémentaire (cracking) ainsi que la production de cyanates cytotoxiques, incompatibles avec l’attache des fibroblastes (30,10). Quel que soit le niveau d’énergie utilisé dans les différents protocoles, les résultats cliniques obtenus lors de surfaçage avec les lasers CO2 et Nd/YAG n’égalent pas ceux obtenus avec un surfaçage mécanique (3). Les études in vivo de Schwartz (2001) sur des dents vouées à l’extraction utilisent le laser Er/YAG et montrent une efficacité supérieure ou identique en terme d’élimination de calculs tartriques sans altération de surface, comparé à un surfaçage manuel aux curettes (29,31,28).
Aoki (2000) (4) compare la technique du surfaçage aux ultra sons avec le laser Er/Yag et trouve des résultats équivalents. L’étude in vitro d’Aoki rapporte un état de surface après traitement laser avec des irrégularités de 15 à 30mm comparables à celles obtenues avec les ultra-sons. Stock (32) montre des résultats comparables en terme de qualité de surface avec l’utilisation de laser Er,Cr /YSGG de longueur d’onde proche (2790nm).
Actuellement seul le laser Er/YAG représente une alternative au débridement radiculaire conventionnel. Il faut ici un laser bien absorbé dans l’eau et l’hydroxyapatite tout en ne générant pas de dommage thermique. C’est donc vers les longueurs d’ondes autour de 3μm donc les lasers Er/YAG et Er, Cr/YSGG, tous deux couplés avec un spray d’air et d’eau qu’un consensus peut être trouvé.
Applications cliniques
Lithotricie et laser Er-YAG
La recherche de méthodologies autres que le surfaçage manuel ou ultrasonique est liée à l’observation selon laquelle une boue cémentaire faite de cellules nécrotiques, d’une matrice organique et de particules cémentaires, interfère avec la migration cellulaire et nuit à la cicatrisation parodontale (61, 62).
L’élimination des dépôts tartriques ne peut se faire avec des lasers thermiques et il a été montré qu’avec des lasers CO2 ou Nd-YAG des zones de carbonisation ou de fusion sont observées au niveau des surfaces cémentaires (45). De plus une libération de cyanates cytotoxiques, incompatibles avec la réattache des fibroblastes ou des kératinocytes peut subvenir (47).
Spencer P, Cobb CM, McCollum MH, Wieliczka DM. The effect of CO2 laser and Nd-YAG with and without air water surface cooling on tooth root structure : correlation between FTIR spectroscopy and histology. J Peridontal Res 1996 ; 31 : 453-462.
CrespiR, Barone A, Covani U, Ciaglia RN, Romanos GE. Effects of CO2 laser treatment on fibroblast attachment to root surfaces. A scanning electron microscopy analysis. J Periodontol 2002 ; 73 : 1308-1312.).
Il ressort de ces études et en toute logique que l’élimination des dépôts tartriques à l’aide de lasers doit faire appel à des lasers dont la longueur d’onde coïncide avec le pic d’absorption de l’eau qui doit être vaporisée par augmentation de pression interne aboutissant à des micro-explosions. C’est l’effet photomécanique.
Les lasers de choix pour l’élimination du tartre sont le laser Erbium, l’Er/YAG et le laser Er-Cr/YSGG. Cependant la rectitude des tips utilisables ne permet pas d’atteindre la totalité de la surface radiculaire, en particulier dans le cas d’une dent pluri-radiculée. La comparaison des états de surface radiculaire, obtenus après détartrage in vitro en expérimentation, aux ultrasons ou aux lasers Er/YAG (46) ou Er, Cr/YSGG (63) montre les mêmes irrégularités (48). Des études in vivo plus récentes, montrent une efficacité supérieure par rapport au surfaçage manuel, sans altération de surface, pour l’Er/YAG (50, 51, 52)
Outre l’effet photomécanique observé Aoki et collaborateurs ont montré dans quelques études très documentées que l’élimination du tartre était quasi identique en termes de temps passé quelle que soit la méthode utilisée.
(Aoki A, Sasaki KM, Watanabe H, Ishikawa I. Lasers in non surgical periodontal therapy. Periodontal. 2004 ; 36 :59-97.
Aoki A, Miura M, Akiyama F. In vitro evaluation of Er-YAG laser scaling of subgingival calculus in comparison with utrasonic scaling. J Periodontal Res 2000 ; 35 :266-277.
Aoki A, Ando Y, Watanabe H, Ishikawa I. In vitro studies on laser scaling of subgingival calculus with an Er-YAG laser. J Periodontol 1994 ; 65 : 1097-1106.)
Pour ces auteurs le niveau d’élimination du tartre était identique quelle que soit la méthode utilisée avec cependant quelques nuances. Le contrôle dans l’élimination du tartre est peut-être plus délicat avec le laser qu’avec les ultrasons même si cette remarque reste très opérateur dépendant.
Dans une étude in vitro (Bezzina-Moulierac ME, 2000) a comparé la possible efficacité d’un laser Er-YAG et celle d’une instrumentation sonique dans l’élimination du tartre sr des dents fraichement extraites pour raisons parodontales. Les résultats nécessitent analyse critique et discussion. Car dans toute étude in vitro des biais sont introduits par comparaison, dans l’interprétation des résultats, à ce qui est observé in vivo car le geste comme le contrôle sont d’autant plus faciles en vision directe.
Il reste que l’élimination totale du tartre y apparait aussi rapide avec laser Er/YAG qu’avec une instrumentation sonique.
L’ablation du tissu cémentaire avec le laser est parfois et de façon irrégulière observée. Un degré de rugosité des surfaces radiculaires est observé dans tous les cas après irradiation. Macroscopiquement, la surface préparée avec l’instrumentation sonique apparaît plus lisse et plus brillante qu’avec le laser Er-YAG. En microscopie à balayage la surface radiculaire montre un aspect plus rugueux et irrégulier par comparaison à l’instrumentation sonique. Enfin après irradiation laser le cément disparaît le plus souvent.
Une rugosité de surface de 20 à 50ìm serait obtenue avec le laser Er-YAG est observée par l’ensemble des auteurs et par Keller.
(Keller U, Stock K, Hibst R. Morphology of Er-YAG laser treated root surfaces. Proc SPIE 1997 ; 3192 : 24-31.)
Mais on sait peu de choses sur l’interaction, rugosité de surface et colonisation fibroblastique de la surface radiculaire dans les processus de cicatrisation. Une fois encore les études futures devraient s’orienter vers la conservation du cément et les techniques de détartrage, l’objectif étant d’obtenir une régénération de l’attache en lieu et place d’un long épithélium de jonction. Des études (58, 64), proposent un traitement conservateur aux paramètres 80 mJ par pulse et 10 Hz, en prenant soin de conserver le cément d’une épaisseur résiduelle de 20 à 25 μm (59), nécessaire à la cicatrisation parodontale (Kathibou et Ghodssi,1983 ; Smart et al., 1990).
L’état de surface des racines traitées avec laser Er/YAG ou détartrage/surfaçage + acide citrique est comparable (60) cependant la technique conventionnelle nécessite un abord chirurgical. Selon certains auteurs, cette surface améliore l'attache des fibroblastes (65, 66). Le surfaçage radiculaire réalisé au laser Erbium laisse en effet une surface radiculaire indemne de boue cémentaire lors d’une utilisation dite à l’aveugle.
Pour Crespi (67) avec l’Er/YAG, 60 mJ :
- le nombre de cellules attachées aux surfaces radiculaires traitées est significativement supérieur au groupe détartrage/surfaçage,
- l’adhésion et la prolifération cellulaire sont améliorées,
- une irradiation des fibres de collagène et des séquences amino-acides est obtenue, ce qui exerce un effet chimiotactique sélectif sur les fibroblastes.
L’utilisation du laser Er/YAG permettrait donc en parodontie non chirurgicale, d’obtenir un conditionnement radiculaire compatible avec une recolonisation cellulaire bien supérieure à celle obtenue par détartrage/surfaçage.
Si le laser Er-YAG est le seul à pouvoir prétendre éliminer le tartre au motif que c’est la seule longueur d’onde absorbée dans l’eau et l’hydroxyapatite, il était souhaitable que ce laser puisse reconnaître, détecter et éliminer ces dépôts de façon sélective. C’est ainsi qu’est née l’idée de l’autofluorescence.
Lithotricie, laser et autofluorescence
Le mode de détection des dépôts tartriques est basé sur l’autofluorescence des acides aminés par excitation laser. Ces acides aminés sont issus du catabolisme des protéines par les bactéries. La protoporphyrine (9) réagit spécifiquement à la longueur d’onde 655nm en absorbant les photons pour les renvoyer en modifiant leur longueur d’onde c’est à dire en émettant une fluorescence de longueur d’onde de 730nm. Le principe est enthousiasmant car il permet en même temps que la détection de commander ou stopper l’émission du laser Er-YAG selon ou non la présence de protoporphyrines.
(Schwartz F, Sculean A, Georg T, Reich E. Periodontal treatment with an Er-YAG laser compared to scaling and root planing. A controlled clinical study. J Periodontol 2001b ;72 : 361-367)
Ces auteurs en comparant l’efficacité du traitement parodontal (détartrage, surfaçage, 160mJ, 10Hz) avec les méthodes conventionnelles mécaniques, sur une durée de 3mois, montre que le gain d’attache est plus élevé avec le traitement laser (0.8mm versus 0.3mm), les autres paramètres cliniques n’étant pas différents.
Une autre étude de Schwarz et al. (2001), compare deux traitements non chirurgicaux laser assisté ou détartrage/surfaçage conventionnel concluant à de résultats
significatifs supérieurs avec l’utilisation du laser Er/YAG :
- une plus forte réduction du saignement au sondage de 56 à 13 % contre 52 à 23 %,
- une réduction de 2 mm des profondeurs de poche contre 1,6 mm,
- un gain d’attache de 1,9 mm contre un 1 mm.
De façon quelque peu contradictoire, comparant laser avec les mêmes paramètres et instrumentation ultrasonique, Sculean montre à 6 mois une réduction du saignement au sondage de 40 à 17% avec le laser versus 46 à 15% avec l’instrumentation ultrasonqiue et un gain d’attache identique quelle que soit la méthode utilisée. Les différences ne sont donc pas statistiquement significatives.
(Sculean A, Schwartz F, Berakdar M, Romanos GE, Arweller NB, Becker J. Periodontal treatment with an Er-YAG laser compared to ultrasonic instrumentation. A pilot study. J Periodontol 2004 ; 75 : 966-973).
Une fois encore le principe reste enthousiasmant mais les résultats contradictoires. De plus il existe encore trop peu d’études sur ce système de détection du tartre et des études complémentaires s’avèrent nécessaires.
Décontamination des poches parodontales
Sauf défaillances acquises ou innées de l’hôte, tout commence sans doute avec la plaque bactérienne qui colonise les surfaces. Fig. 5
De façon très schématique, on peut considérer qu’il appartient alors aux bactéries de coloniser, de se multiplier, de contourner les défenses de l’hôte et de
produire des substances capables de lyser les tissus parodontaux, de libérer des enzymes et autres
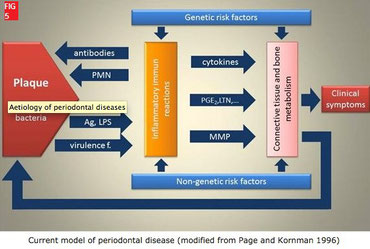
substances cytotoxiques, de déclencher la synthèse d’enzymes lytiques « dormantes » chez certaines cellules eucaryotes présentes dans le parodonte et d’activer les cellules de l’immunité qui vont alors libérer des médiateurs inflammatoires à l’origine de destruction tissulaire. L’invasion des tissus parodontaux devient possible (exemple : A. Actinomycetemcomitans, P. gingivalis. F. nucleatum) jusque dans l’épithélium
La décontamination bactérienne réalisée aux antibiotiques est de type chimique, celle effectuée par l’irradiation laser est de type physique. C’est peut-être là que le laser ou plus précisément certains d’entre eux, peuvent intervenir par leur pouvoir de pénétration et leur absorption en profondeur dans les tissus. C’est peut-être là encore que l’utilisation de lasers thermiques trouve sa place. La propriété bactéricide des lasers est liée à la quantité d’énergie délivrée par les différentes longueurs d’ondes et leurs spectres d’absorption (53).
Le problème posé est donc celui du compromis entre destruction bactérienne et respect des cellules impliquées dans la réparation tissulaire.
Les lasers et la parodontie non chirurgicale
Il s’agit de réaliser un traitement adapté et personnalisé suivant un protocole rigoureux prédéfini, dont la conception a été établie à partir du recueil des données cliniques, radiologiques et l’établissement du diagnostic.
Une remarque d’importance : certains auteurs préconisent une décontamination initiale qui correspond à une application laser par balayage, faite avant toute instrumentation exploratrice. L’objectif de cette irradiation est de réduire la masse bactérienne de la poche, minimisant ainsi le risque de bactériémie et de translocation microbienne causée par l'instrumentation, d'abaisser le contenu microbien dans les aérosols créés au cours de l'instrumentation ultrasonore (35).
Le procédé : un Laser fibré (KTP, Diode ou Nd/YAG) est utilisé. La fibre est placée à l'intérieur du sillon puis balayée lentement, à faible énergie, pendant 7 à 8 secondes, verticalement et horizontalement, à distance de la dent, sur toute sa périphérie.
L’objectif du traitement parodontal conventionnel est :
- l'élimination du biofilm,
- l’obtention d’un cément indemne de tartre, de bactéries et d’endotoxines bactériennes,
- l’éradication concomitante, des bactéries au sein des tissus mous environnants, afin d’éviter tous risque de recontamination. (12)
Cependant le traitement conventionnel ne permet pas d’action antibactérienne en profondeur au niveau du cément ni au niveau des tissus mous de la poche qui contient des bactéries intracellulaires peu accessibles aux antibiotiques telles le Phrophyromonas Gingivalis.
L’action du surfaçage radiculaire sur la racine est identique à celle du laser qui élimine le biofilm des murs osseux et muqueux de la poche parodontale. De plus, l'énergie du laser interagit fortement avec les chromophores présents en grande quantité dans un tissu inflammatoire. Cette thérapie laser non chirurgicale utilise paramètres de distribution d’énergie, très faibles. (21)
Les lasers présentent de nombreux avantages :
- pas de résistance bactérienne
- pas de réaction allergique
- pas d’interaction médicamenteuse
- irradiation totale sur les tissus mous (épithélium de la poche, tissu de granulation) et sur les tissus durs (cément et os)
- le cément est irradié avec une action bactéricide sur 1mm de profondeur. (Diodes, Nd/YAG)
- inactivation des protéases et des cytokines (PDT)
- destruction effective du biofilm qui est une barrière aux antibiotiques
- destruction des bactéries intracellulaires (Ex : PG) non accessibles aux antibiotiques et qui représentent une source de réensemencement.
La parodontie non chirurgicale est basée sur le contrôle microscopique fréquent de la composition bactérienne de la plaque dentaire, afin de contrôler le développement des bactéries parodonto-pathogènes du complexe rouge de Socransky au sein du biofilm.
Le tartre est éliminé des surfaces radiculaires. Le cément est préservé et l’attache épithélio-conjonctive est respectée.
Lasers thermiques
Les lasers utilisés dans notre discipline peuvent être le laser KTP, les lasers Diodes, les lasers Nd-YAG et Nd-YAP à l’exclusion du laser CO2 qui ne peut être fibré. Chacun de ces lasers peut être utilisé avec des fibres de 200 ou 320ìm. Ces fibres permettent d’accéder en fond de poches en toutes situations topographiques et de faibles énergies d’affichage (« output power ») évitent des dommages thermiques pour les tissus environnants.
L’irradiation est appliquée pendant des temps courts, pour des fluences faibles afin de créer une hyperthermie modérée (quelques degrés). En aucun cas sera recherchée la coagulation qui correspond à une nécrose irréversible, conséquence de la dessiccation.
L’irradiation de la poche se fait en partant du fond de la poche pour se diriger vers la partie coronaire en un mouvement hélicoïdal. Certains auteurs proposent d’irriguer avec des solutions antiseptiques, (Ex : Bétadine + peroxyde d’oxygène).
On pourrait penser que les lasers thermiques fibrés utilisés (Diodes, Nd-YAG, Nd-YAP, KTP) n’étant pas absorbés dans cette solution aqueuse, la synergie
laser-irrigant n’aurait pas lieu et ne servirait à rien. En fait, dès lors que la fibre se meut en fond de poche elle provoque un saignement, qui modifie la couleur de l’irrigant qui devient le
chromophore adapté pour ces longueurs d’ondes. Fig 6 / Fig 7
Andersen R, Loebel N, Hammond D, Wilson M. Treatment of periodontal diseases by photodisinfection compared to scaling and root planing. J Clin Dent. 2007;18:34–8. [PubMed]
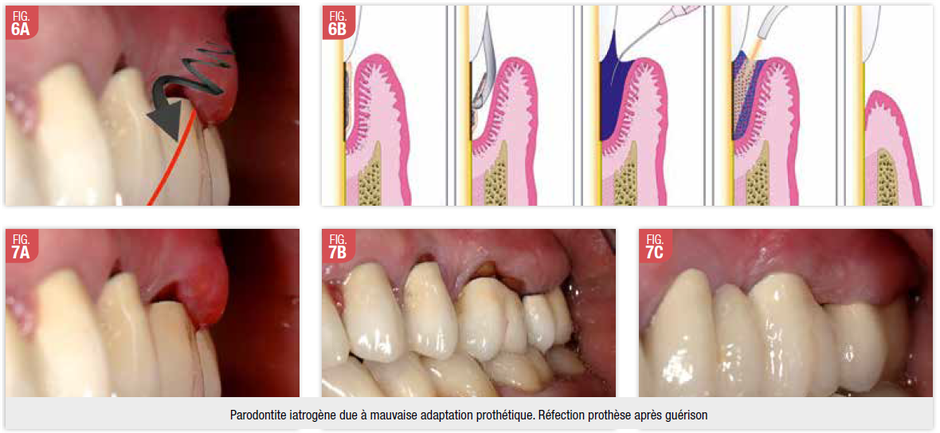
Des études in vivo montrent une réduction plus efficace des bactéries pathogènes lors de l’utilisation du laser Nd/YAG, par rapport au surfaçage radiculaire seul. En l’absence de maintenance, la recolonisation bactérienne s’opère de façon identique dans les deux cas (54).
D’autres études, couplant le laser Nd/YAP au surfaçage conventionnel, ne démontrent aucun avantage à trois mois en termes de recolonisation bactérienne (55).
Des études in vitro utilisant des Diodes, montrent des effets différents sur le morphotype des bactéries en fonction de l’énergie délivrée. Si l’énergie distribuée est insuffisante et non létale, il se peut que l’irradiation du laser diode puisse stimuler le développement bactérien par phénomène de biostimulation(57).
Les lasers fibrés Argon, KTP, Nd/ YAG et Diodes présentent une forte absorption dans les chromophores, en particulier les bactéries pigmentées telles le Porphyromonas Gingivalis et Prevotella Intermedia ; étroitement associées aux parodontites. (16 Les tissus parodontaux de la poche sont débridés aux paramètres non iatrogènes dont l’effet thermique ne doit pas dépasser une température de 60°C, (24). Le tissu sain sous-jacent est biostimulé. Moritz et al. ont démontré que l’indice de saignement était amélioré chez 96,9% des patients traités par thérapie laser Diode assistée, versus 66,7% des patients traités par thérapie conventionnelle (14, 26)
La distribution de l'énergie laser vers les tissus affectés à des intervalles spécifiques et répétés est un élément clé dans le succès du traitement parodontal. La fibre positionnée en fond de poche l’irradiation est effectuée à basse énergie et pour des temps courts (5 secondes pour 10 passages maximum) en remontant, par balayage, vers le collet clinique. Le temps d’irradiation dépendra de la durée choisie des pulses de façon à laisser aux tissus un temps de relaxation thermique. Le renouvellement de la solution d’irrigation est nécessaire afin de contrôler l’élévation thermique tissulaire. De plus, l’adjonction de la Bétadine à l’eau oxygénée permet d’augmenter l’absorption de la longueur d’onde au sein de l’irrigant et la dissociation de l’eau oxygénée en radicaux libres.
Aux paramètres appropriés, la plupart des bactéries non sporulantes, y compris les bactéries anaérobies, sont facilement inactivées à 50°C (21,22).
Une étude de Qadri (69) démontre à :
- 3 mois, détartrage/surfaçage + laser Nd/YAG refroidi par spray d’eau, améliore significativement les signes cliniques associés à l’inflammation parodontale versus détartrage/surfaçage seul.
- 9 mois, détartrage/surfaçage + Nd/YAG est plus efficace que détartrage/surfaçage seul (Profondeur de poche : PPD, Gain d’attache : CAL, Indice gingival : GI, et Fluide créviculaire : GCF)
La recolonisation possible est contrôlée et retardée par une maintenance utilisant la thérapie photodynamique (PDT, confère ci dessous).
Lasers photoablatifs
Les lasers CO2 et Erbium ont également d'excellentes propriétés bactéricides. (17,18). Ils agissent sur les agents pathogènes par effet thermique sur leurs liquides intracellulaires (19,20). Absorbés dans l’eau, présente dans les tissus parodontaux, dans les bactéries et les éléments cellulaires figurés, ils sont susceptibles de diminuer la charge bactérienne mais aussi d’interagir avec les cellules impliquées dans les processus de défense. En fait, l’interaction peut se définir comme une ablation de matériel sans effet thermique sur les berges. C’est le domaine des lasers Er-YAG et Er, Cr :YSGG.
Le mécanisme initial est une conversion de la lumière en chaleur mais très superficielle, sans diffusion, combiné avec une vaporisation explosive (effet mécanique), C’est ce dernier effet qui permet une rupture des parois bactériennes et une diminution de la charge observable extemporanément en microscopie optique au fond noir.
La comparaison détartrage laser Er/YAG versus détartrage ultrasonique montre une réduction des bactéries pathogènes sensiblement identique (56).
L’étude in vitro au laser CO2 démontre que pour obtenir un effet bactéricide l’irradiation doit être directement appliquée sur les bactéries (53).
En clinique, le rayonnement direct ne peut pas être obtenu avec un laser non fibré. Il faut donc s’éloigner des concepts de parodontie médicale et choisir la voie chirurgicale à ciel ouvert pour obtenir un accès direct.
Parodontie et thérapie photodynamique (PDT)
La thérapie photodynamique est basée sur l’action cytotoxique assumée par des agents photosensibilisants, lorsque ces derniers ont été exposés à une lumiére de longueur appropriée. (Dougherty et al. 1998). L’agent photosensibilisant doit être porté en fond de poche parodontale avant irradiation.
La PDT en parodontie consiste en une coloration des bactéries parodontopathogènes de la poche par un Photosensibilisant dont l’irradiation, à l’aide d’une longueur d’onde spécifique, induit un stress oxydatif bactéricide.
La PDT est une méthode alternative et sélective pour l'élimination de bactéries parodontales de la poche sans effet iatrogène pour les tissus environnants. L’utilisation répétée de la PDT au niveau de poches résiduelles offre un résultat clinique significativement supérieur à celui obtenu par le seul débridement conventionnel (73). (Fig. 8)
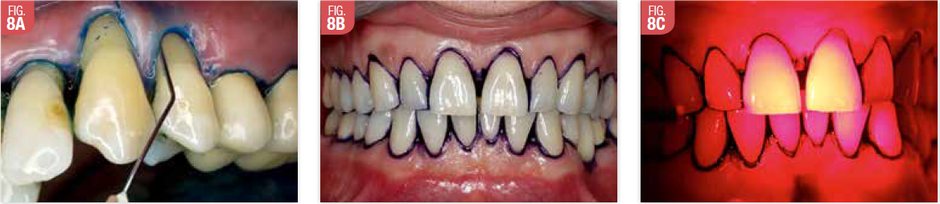
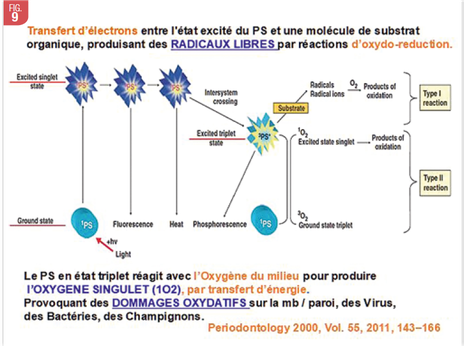
Fig 9
Une étude plus récente évalue, in vitro, l’effet bactéricide d’un laser diode 830 nm associé au bleu de toluidine (TBO) sur les bactéries : Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Fusobacterium nucleatum et Prevotella intermedia.
L’association de TBO au laser 830 nm est efficace pour l’éradication des bactéries et la photo-inactivation du biofilm. (74) Braham P. montre également que la PDT réduit la viabilité de P. gingivalis, inhibe l'activité de la protéase et inactive les cytokines (75).

La PDT associée au traitement parodontal :
- est impliquée dans la destruction des bactéries du biofilm parodontal,
- inactive des facteurs de virulence bactériens,
- inactive les cytokines hôtes qui détériorent la cicatrisation parodontale
Selon Takasaki AA, (76), l’application de PDT antimicrobienne sans chirurgie parodontale donne des résultats probants supérieurs à la technique SRP seule associé à une réduction de l’inflammation, du saignement et un gain d’attache.
Thérapeutique d’avenir, la PDT peut remplacer les antibiotiques locaux voire systémiques et améliorer le résultat des traitements conventionnels. La PDT en parodontie est indiqué dans la prise en charge et la maintenance des patients fumeurs et immunodéprimés.
La PDT aurait une efficacité supérieure aux antibiotiques.
Nastri L, Donnarumma G, Porzio C, De Gregorio V, Tufano MA, Caruso F, Mazza C, Serpico R; Effects of toluidine blue-mediated photodynamic therapy on periopathogens and periodontal biofilm: in vitro evaluation. Int J Immunopathol Pharmacol. 2010, Oct-Dec;23(4):1125-32.
La PDT est également indiqué dans la prise en charge des parodontites agressives, et ce, en particulier au niveau de la maintenance parodontale dont le contrôle qualitatif du biofilm est un facteur clef. Mais il n’existe pas à ce jour de consensus pour l’application de cette méthode dans la gestion des parodontopathies.
Parodontie et LLLT (Low Level Laser Therapy) : les soft lasers
La LLLT contrôle les processus de l’inflammation aiguë et chronique (26). La photo-biomodulation réduit l’œdème post-opératoire, stimule les cellules endothéliales, la synthèse des fibres de collagène associée à un remodelage de la matrice extracellulaire. (27, 28, 29)
La diffusion de la chaleur, qui crée un gradient avec une énergie variable selon les lasers utilisés, peut avoir des effets au-delà de la photo-biomodulation directe.
Deux méta-analyses (Photomed Laser Surg. 2004 Jun; 22(3) : 241-7. Photomed Laser Surg. 2004 Aug; 22(4) : 323-9.) construites à partir de 24 études retenues dont les longueurs d’ondes sont comprises entre 514 et 904nm montre que la LLLT accélère la cicatrisation des tissus mous et diminue les douleurs post-opératoires. Les résultats les plus significatifs sont ceux obtenus à partir d’une longueur d’onde de 632,8nm.
Fig. 12 - Ozcelik O, Cenk Haytac M, Kunin A, Seydaoglu G; Improved wound healing by low-level laser irradiation after gingivectomy operations : a controlled clinical pilot study. J Clin Periodontol. 2008 Mar;35(3):250-4.
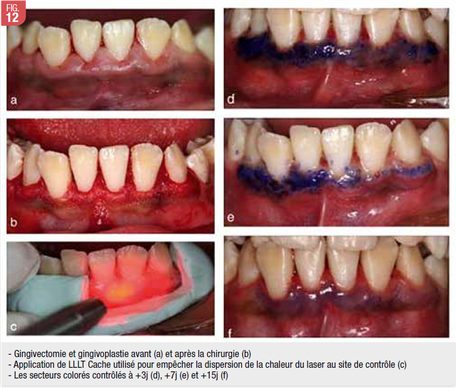
Ainsi la LLLT est utilisée pour stimuler la cicatrisation, obtenir une analgésie, accélérer de la régénération tissulaire et améliorer de la résistance cellulaire. La LLLT déclenche des réactions photochimiques, produites par des énergies faibles couplées à des temps d’application longs. Karu suggère que ces effets sont causés par une augmentation de l’activité mitochondriale (30).
La LLLT active la biochimie cellulaire par le biais d’un double mécanisme :
- un mécanisme direct par action photobiologique (chaîne respiratoire) et activation des chaînes redox cellulaires (augmentation de l’ATP) ;
- un mécanisme indirect par activation des cellules à travers des messagers secondaires.
L’amplitude des effets biostimulants serait liée à l’état physiologique de la cellule au moment de l’irradiation (71, 72). Il n’y a pas de consensus pour ce qui est des fluences montrant une action biostimulante. L’hypothèse la plus probable semble liée à une fenêtre d’action comprise entre 0,05 et 10 J/cm².
On peut citer des études spécifiquement appliquées aux traitements parodontaux conventionnels qui corroborent les hypothèses avancées. L’étude de Quadri (69) realisée en split-mouth, double aveugle contrôlé, sur 17 patients présentant une parodontite modérée, montre les effets de la LLLT (Diode 635nm et Diode 830nm) appliquée une semaine après traitement conventionnel détartrage/surfaçage puis chaque semaine pendant 6 semaines. Les résultats montrent des paramètres cliniques et biologiques (profondeur de poche, indice de plaque, indice de saignement, dosage IL1β et MMP8) améliorés.
Une étude plus récente (70), confirme ces résultats pour les patients fumeurs dont le traitement non-chirurgical est effectué seul ou en association avec la LLLT. Les groupes fumeurs présentent des différences cliniques significatives. Cependant, les différences s’atténuent à 6 mois.
Au niveau osseux, d’autres études montrent une augmentation de l’activité de la phosphatase alcaline, du nombre de vaisseaux sanguins, des prostaglandines et de la différenciation ostéoblastique.
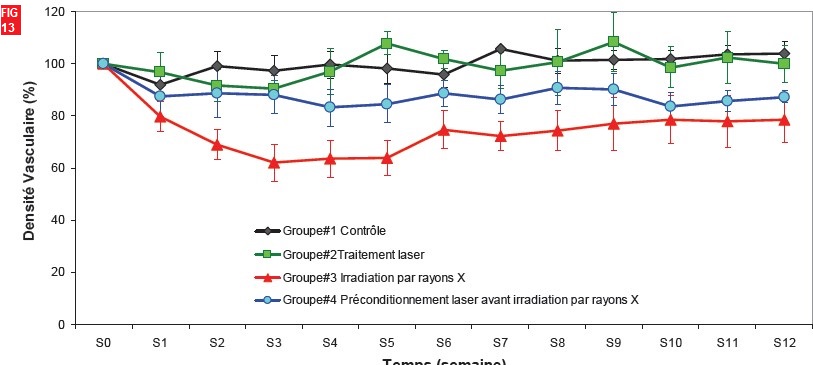
S. Desmons (Thèse Université Lille, 2008) démontre également une augmentation de la formation des HSP « Heat Shock Proteins 70 » dans les zones osseuses irradiées aux rayons X, du nombre des néo-ponts vasculaires formés ainsi qu’une résistance cellulaire et tissulaire accrue à toute irradiation secondaire de cet os préconditionné par LLLT.
La thérapie par lasers de faible énergie favorise et améliore la cicatrisation osseuse.
Fig. 13 - Sophie Desmons (Thèse Université Lille, 2008)
Discussion
Le contrôle de l’efficacité des méthodes de décontamination extemporanée passe par les examens directs et principalement :
- la microscopie à fond noir (contraste de phase) permet de visualiser et différencier les morphotypes présents et donc d’obtenir une information qualitative et quantitative sur la densité microbienne. Peuvent être observés les spirochètes et spirilles, les bactéries mobiles, bacilles, cocci, fusiformes, amibes, trichomonas mais aussi le nombre et la qualité des cellules épithéliales et des PMNs.
- la coloration de Gram : facile à mettre en œuvre, elle a pour avantage principal la collection des échantillons fixés.
Le contrôle passe aussi par les techniques de PCR en particulier lorsqu’est recherchée l’identification de facteurs de virulence associés à une espèce bactérienne. Cette technique, couteuse, sera réservée aux cas de parodontite agressive ou de parodontite réfractaire aux traitements.
A moyen et long terme la décontamination des poches parodontales laser assistée peut être renouvelée autant de fois que nécessaire lorsque les indices révèlent une période d’activité (pertes d’attache).
Dans la littérature quelques contradictions existent et le consensus ne semble pas acquis à ce jour. Les problèmes posés concernent la re-contamination des poches, l’incertitude pour ce qui regarde l’élimination les bactéries intra- tissulaires et parfois même l’intérêt de l’assistance laser par comparaison aux méthodes traditionnelles. Les travaux futurs devraient permettre de lever ces contradictions.
Chirurgie des tissus mous et des tissus durs Fig 14 / Fig 15
La procédure laser présente de nombreux avantages :
- confort du patient,
- pas d’effet iatrogène aux paramètres donnés,
- cicatrisation accélérée médiée par une biomodulation,
- contrôle de la douleur et de l'œdème post-opératoire,
- hémostase et coagulation si nécessaire.
La thérapie au laser a de multiples usages en parodontie chirurgicale. Elle peut être une alternative à l’électrochirurgie. Différentes longueurs d’ondes (CO2, Er/YAG, Nd/YAG, Diodes, KTP) sont utilisables.
Le choix de la longueur d’onde dépendra du type de chirurgie souhaitée non exsangue (Er/YAG) ou exsangue (CO2, Nd/YAG, Diodes, KTP) et du choix du processus de cicatrisation selon l’élévation thermique du tissu adjacent induite par l’exérèse.
Les indications principales en chirurgie des tissus mous et durs laser-assistée sont :
- les frénectomies,
- la chirurgie muco-gingivale : gingivectomies, gingivoplasties,
- la gestion des hypertrophies tissulaires,
- l’exérèse de tumeurs bénignes (fibromes, mucocèles, diapneusies, verrues, papillomes),
- le « décapuchonnage » des dents de sagesse,
- l’operculisation des implants lors de la mise en fonction,
- le plastie gingivale pré-prothétique ou orthodontique,
- la coagulation,
- l’incision et le drainage d’abcès,
- le traitement des ulcérations (aphtes et herpès),
- la vestibuloplastie,
- le débridement sulculaire pour améliorer les indices cliniques (saignement gingival, profondeur des poches, perte d’attache),
- le traitement des péri-implantites,
- le gommage (peeling) et de désépaississement tissulaire,
- la gestion des sourires gingivaux,
- l’élongation coronaire,
- les ostéotomies, les ostéoplasties (laser Er/YAG ou laser Er-Cr/YSGG).
Paro-implantologie et lasers
Le problème de la préparation des sites implantaires fait partie de la recherche fondamentale et clinique et donc n’est pas à ce jour résolu. Nous savons que l’association laser Er- YAG et CFAO permettra peut-être de scanner le site à implanter puis de définir les paramètres de préparation du site et enfin de réaliser la prothèse supra-implantaire.
Mais à ce jour l’assistance laser n’est utilisée que dans deux directions principales : operculation (2nde phase implantaire) et décontamination en présence de péri-implantites.
Seconde phase implantaire. Stade II
Plusieurs longueurs d’ondes peuvent être utilisées. Cependant la structure de l’implant et sa couleur (blanche pour certains implants recouverts d’hydroxyapatite, gris pour les implants titane) peuvent théoriquement influer sur le choix de la longueur d’onde. Tous les lasers thermiques sont aptes à gérer l’exérèse du tissu gingival pour operculiser les têtes d’implants.
Gestion des péri-implantites
Le traitement de la péri-mucosite et de la péri-implantite est superposable à celui de la gingivite et de la parodontite. La périmucosite n’entraine pas de perte osseuse. L'essentiel du traitement consiste à éliminer et contrôler le biofilm au niveau col implantaire et de la couronne. L’utilisation de la PDT ou de laser peut être un traitement associé.
Concernant la péri-implantite, la prise en charge non chirurgicale dite à l’aveugle, ne permet pas un accès direct à la surface implantaire; seuls les tissus mous sont irradiés. La prise en charge d’une péri-implantite nécessite une technique à ciel ouvert afin de décontaminer les spires et la restaurer une couche d’oxyde de titane (TiO2) nécessaire à la recolonisation par les cellules osseuses (77). Cette couche d’oxyde obtenu, une technique associant une régénération osseuse guidée ROG, combinant une membrane à une greffe osseuse est nécessaire (78).
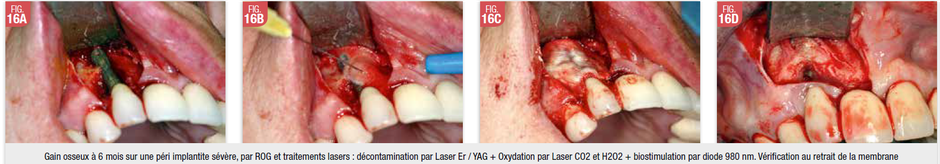
Mais le phénomène étant de nos jours de plus en plus prévalent, nous allons développer ce chapitre qui peut faire l’objet d’un livre, à lui seul.
Les maladies péri implantaires atteignent 45 à 55 % des patients implantés (Berglundh et al 2004), dont 7 à 14% présentent des pertes sévères avec saignements et pus (Roos-Jansåker AM et al, 2006). L’étiologie de ces maladies et leur pathogénie sont complexes à cerner et leurs traitements restent difficiles surtout s’il y a tabagisme, gros facteur de risque. Il n’existe pas de méthode capable, de prédire, de résoudre et de résorber les pertes dues aux péri-implantites,
Les infections péri implantaires sont dues à une réaction inflammatoire avec perte concomitante d'os support dans la zone marginale de l’implant après sa mise en fonction (Kao et al, 1997).
On rappelle que les critères de succès de la bonne ostéo-intégration d'un implant sont :
- l‘établissement d'un contact direct : implant / os,
- la présence de tissus péri-implantaires (durs et mous) sains (Cochran et a/. 1997 ; Schroeder et al, 1981).
En première remarque, on doit différencier les atteintes inflammatoires implantaires :
- les réversibles, les mucosites,
- les irréversibles avec pertes osseuses, les péri implantites
En seconde remarque, il faut déterminer de manière exhaustive, les étiologies possibles, liées aux échecs implantaires de manière à établir avec efficacité la stratégie thérapeutique à sélectionner pour espérer obtenir une ré-ostéo intégration des implants atteints.
Sur le plan clinique, la péri implantite est l’échec de l’ostéo-intégration, caractérisé par une mobilité ou non, de l’implant (Esposito et al, 1998). Un implant présentant une péri-implantite, peut être stable cliniquement, mais est caractérisé par une perte osseuse périphérique de classe (I ou II) et par la formation d'une poche (Zablotsky et Kwan, 1994).
On se doit de rappeler que la rugosité de surface de l’implant joue un rôle majeur dans le processus de colonisation bactérienne.
- Les implants à surface rugueuse ont plus grande prévalence de péri-implantites (J. Clin. Periodontol. 2008). De même que les antécédents de parodontite chez les patients sont des prédispositions à des péri-implantites (I.K.Karoussis, et al 2003)
- Patients à antécédents de parodontite chronique (incidence 28,6%)
- Patients indemnes de parodontite (incidence 5,8%)
Les résorptions osseuses peuvent être sévères et différentes propositions thérapeutiques de ces péri implantites ont été présentées, du traitement a minima par simple décontamination et désinfection, aux traitements complexes avec curetage et antibiothérapie associée.
Toutes ces méthodes copiées sur celles utilisées dans le traitement des parodontites, n’ont pas permis de ré-ostéointégration complète. Les résultats sont souvent aléatoires. La régénération osseuse guidée a été utilisée, mais les preuves d’une ré-ostéointégration n’ont pas été établies.
Le cahier des charges du traitement des péri implantites doit satisfaire à :
- l’élimination complète des contaminants de surface ;
- la non modification de la surface initiale de l’implant ;
- le rétablissement de la composition atomique initiale de TiO2.
En aucun cas le traitement ne doit perturber ou contrarier une possible cicatrisation tissulaire. Une ré ostéo-intégration est espérée après le traitement. (Renvert S, et al 2009).
Les lasers peuvent ils contribuer à des solutions plus fiables dans ces thérapeutiques ?
Le traitement non chirurgical des péri implantites
L’élimination de la plaque bactérienne a été recommandée par des thérapies mécaniques et chimiques :
- débridement non chirurgical de la lésion,
- antiseptiques locaux et/ou systémiques
En suivant les mêmes principes que pour le traitement des parodontites. (Mombelli A. et al,1997, Ericsson I. et al, 1996).
Mais le traitement mécanique seul à l’aide de curettes et/ou d’ultra sons n’a pas été assez efficace. (Kotsovilis S, et al, 2008).
Parfois l’adjonction d’un traitement chimique local ou systémique par antiseptique (CHX 0,2%, Iode, H2O2) et/ou antibiotique (Ornidazole, Amoxicilline + Ac Clavulanique, Tétracycline, Doxycycline, Minocycline) peut améliorer les résultats, (Lindhe J et al, 2008. Renvert S, et al 2008) mais le contrôle de plaque demeure permanant, tous les 3 mois pour les patients avec des antécédents de parodontite.
Le traitement chirurgical des péri implantites
La chirurgie doit être réalisée après l’élimination de l’inflammation et l’arrêt de la progression de l’infection. Le but est de réaliser une chirurgie d’accès par lambeau d’assainissement suivi d’une décontamination de surface. Mais cette solution est insuffisante.
On peut pratiquer une gingivectomie pour réduire la profondeur de la poche, voire pratiquer un fraisage des spires exposées de l’implant, puis un polissage. (Bercy P, Tenenbaum H, 1996. Romeo E, et al. 2007).
On peut tenter une régénération osseuse guidée pour remplir le défaut osseux par :
- greffe osseuse de comblement (BG), et régénération osseuse guidée (GBR) en sélectionnant différents matériaux de greffe,
- os autogène et biomatériaux qui seront mis au contact de la surface de l’implant. Dans la plupart des cas, on obtient une amélioration de la situation clinique. (Claffey N, et al, 2008).
L’innovation du traitement des péri implantites à l’aide des lasers
En partant du principe que les lasers offrent beaucoup d’avantages :
- pas de résistance bactérienne,
- pas de réaction allergique possible,
- pas d’interaction médicamenteuse,
- l’irradiation des tissus mous et durs est totale (épithélium de la poche, tissu de granulation, parois osseuses résiduelles),
- destruction des bactéries intracellulaires (PG) des tissus mous de recouvrement, non accessibles aux antibiotiques et représentant une source de re-contamination,
- désinfection des surfaces Ti des implants lisses, TPS, HA ou SLA,
- pouvoir bactéricide,
- élimination des toxines bactériennes,
- élimination des lipo-polysaccharides (LPS)
On peut, en plus, s’appuyer sur des études de plus en plus nombreuses sur les effets physiques de l'irradiation des lasers utilisables en dentisterie, sur les surfaces des implants titane et en particulier sur celle de Kreisler M, et al, (2002)
D’autres études, portent sur les effets biologiques, influencés par l’irradiation laser du titane, en particulier celle in vitro, de Lee et al. (2008), qui était d'étudier les réponses de croissance et de prolifération d’ostéoblastes ensemencés sur des disques de titane anodisé, irradiés à l'aide d’un laser CO2 ou d’un laser Er, Cr/YSGG.
La prolifération cellulaire est plus active sur les disques traités avec l’Er, Cr/YSGG à 300 J / cm2. Cette étude montre que l'irradiation avec un laser (CO2 ou Er, Cr/YSGG dans cet exemple) peut induire une prolifération et une différentiation cellulaire quantifiable. La méthode a été inspirée par l’étude non quantifiée de Romanos G, et al, en 2006.
Les études les plus édifiantes ont été basées sur l’utilisation de l’Erbium, qui paraît devenir la longueur d’onde la plus universellement utilisée en dentisterie. Les japonais Matsuyama T, et al (2003) démontrent que le laser Er/YAG à 30 mJ par pulse, 30 Hz avec spray permet de débrider les piliers implantaires sans altérer leurs surfaces, en éliminant efficacement la plaque dentaire et le tartre.
Les contreverses sont cependant possibles. Ainsi, Schwarz F, et al, 2006, montre que l’Er, Cr/YSGG, même s’il démontre une grande efficacité dans l'élimination du biofilm de la plaque, ne permet pas de rétablir à coup sur la biocompatibilité du titane car son influence est très dépendante de la façon de distribuer l'énergie. Pour Takasaki AA, et al (2007) l'utilisation de Er: YAG à 100mJ par pulse et spray, dans le traitement des péri implantites, est plus efficace et plus sure que l’utilisation de curettes en plastique, pour le débridement de la surface de l'implant et dans le retrait du tissu de granulation environnant, favorisant même, une croissance osseuse plus importante.
Mais d’autres études, utilisant des lasers CO2 sont à prendre en considération pour le traitement des péri-implantites, avec ou sans greffes osseuses de biomatériaux plus membranes. Leurs résultats in vivo sont appréciables. (Romanos G, et al 2008).
Avec des protocoles très bien définis, les lasers diodes, peuvent être utilisés dans ces traitements des péri implantites, mais les variétés des longueurs d’ondes utilisables, les protocoles et les paramètres nombreux sont difficilement interprétables. Les Nd/YAG sont difficilement utilisables sur les surfaces des implants, car ils chauffent exagérément le métal et provoquent des altérations physiques du Ti. (Kreisler M. et al 2002).
Les méthodes de traitement des péri implantites
Les résultats de croissance osseuse des méthodes conventionnelles
La croissance osseuse est variable en fonction de la technique utilisée. L’étude de Nociti Júnior FHet al, (2001) le démontre par ses résultats :
- débridement (DE) présente 14, 03% de croissance osseuse,
- DE + GBR = 21,78 % de croissance osseuse
- DE + BG = 21,26% de croissance osseuse
- DE + GBR + BG = 27.77% de croissance osseuse
- DE + détoxification de la S2 implantaire + greffe osseuse + membrane donne le meilleur résultat, soit 38,03% de croissance osseuse.
Donc la détoxification de la surface de l’implant augmente de 10% les résultats lors d’une greffe osseuse de comblement au niveau d’un site détruit par la péri implantite.
Ainsi, l’effort chirurgical doit être fait à ce niveau car la surface TiO2 est chimiquement dynamique provoquant une réaction histologique à l’interface Ti / Os. (Clark AE, Hench LLet al.,1976)
La surface implant TiO2 peut être considérée comme un biomatériaux utilisant des protéines et des cellules du site implantaire, et permettant une réponse tissulaire maximum (Ratner B.D, 1993)
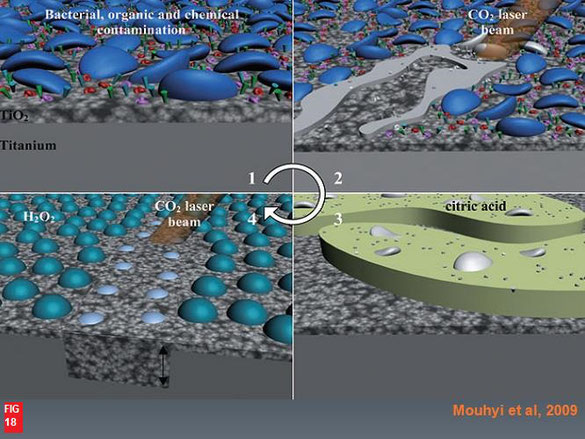
Le TiO2 passive les agents destructeurs d’os après la blessure de l’os. En particulier l’H2O2 produit par les PMN (1ère réaction de défense contre un agresseur pathogène) (Mouhyi J, et al 2009).
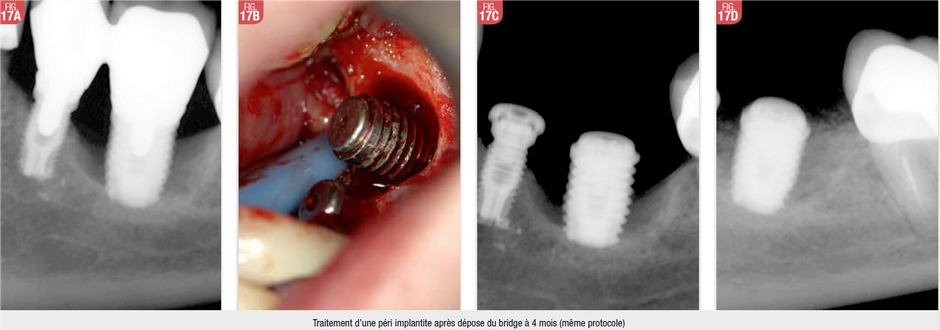
Les méthodes physico-chimiques de décontamination de S2 des implants
Classiquement on a proposé :
- les ultrasons + le Tri-Ethanol : pas utilisable cliniquement (Walrvaara et al, 1992)
- Le Phrophy-jet + Chloramine T 1% : mais on obtient des microabrasions et des contaminations de la surface de l’implant par le Na+ (Zablotsky et al, 1992)
- Le Prophy-jet + Ac Citric : on trouve aussi des microabrasions (Jovanovic et al, 1993)
Comme la contamination atomique modifie la biocompatibilité d’un biomatériaux (Bjursten et al, 1985), la méthode lasers de décontamination préconisable est le traitement chirurgical à ciel ouvert avec passage d’un Laser Er ou CO2, surtout si l’implant atteint est important dans une reconstitution prothétique et ce de la manière suivante :
- passage laser pour la carbonisation et la vaporisation des bactéries et des débris inflammatoires en mode pulsé de la S2 par laser CO2 à 8 W, 10 ms, 20 Hz, pendant 5 s / par laser Er/YAG à 300mJ maximum, 10Hz sur la surface SLA / par laser Er/YAG 350mJ, 10Hz sur la surface polie (Stubinger S et al, 2006),
- passage d’Ac citric 30s, pour détacher les traces de carbonisations du Ti (si utilisation du C02),
- rinçage au sérum physiologique pendant 2 min,
- application d’H2O2 à faible concentration, comme source d’O2,
- l’H202 est pré évaporé par passage laser CO2 pour obtenir la Passivation du Ti (2H2O2→2H2O + O2)
fig 18
Mais il ne faut pas imaginer que cette technique permet de rattraper toutes les situations implantaires difficiles. L’implant contaminé doit être retiré si les conditions d’accès sont difficiles ; si la perte osseuse équivaut à plus de la moitié de la hauteur de l’implant
On peut prévoir la reconstitution osseuse du site, et la réimplantation sera différée.
Conclusions
Les lasers Erbium sont les plus polyvalents en parodontologie. Le traitement parodontal assisté au laser Er/YAG est une alternative au traitement chirurgical conventionnel.
Leur utilisation conduit à des résultats comparables voire supérieurs aux procédures conventionnelles :
- ils permettent le débridement et la décontamination des tissus parodontaux ;
- ils laissent une surface radiculaire exempte de boue cémentaire compatible avec la ré-attache et la régénération tissulaire ;
- ils améliorent les résultats cliniques à 3 mois ;
- ils désorganisent de façon efficace le biofilm au niveau des poches profondes (plus de 5mm).
La PDT en applications multiples est indiquée dans la prise en charge parodontale. Elle semble plus efficace que la maintenance conventionnelle en particulier pour les patients fumeurs, immunodéprimée et pour les patients présentant une parodontite agressive de par le contrôle qualitatif exercé sur le biofilm.
L’association des deux thérapeutiques est une solution d’avenir dont l’évaluation serait à effectuer.
Si la prise en charge parodontale nécessite une stratégie multiple, les agents chimiques tels la doxycycline, la tétracycline ou le métronidazole peuvent être utilisés en complément. En dépit de l’action bactéricide de la PDT et des lasers Erbium, un protocole permettant de s’affranchir de toute antibiothérapie reste à définir.
Les lasers s’inscrivent aujourd’hui naturellement dans l’arsenal thérapeutique en parodontie. De plus, ils apportent un confort de travail associé à de faibles suites opératoires. L’utilisation des lasers dentaires, en complément avec ou en remplacement des méthodes traditionnelles de la parodontologie et de l’implantologie, sera indispensable en chirurgie dentaire contemporaine (Walsh LJ, 2003) dans la mesure où l’irradiation laser qui stimule la production des Heat Shock Proteins (HSP) aussi bien au niveau gingival, qu’au niveau osseux permet d’optimiser la cicatrisation des tissus. (Desmons S., 2008)
Les lasers peuvent être considérés comme des outils prometteurs. Les protocoles opératoires restent à préciser pour des résultats optimisés. Ce travail méthodologique fera des lasers, des outils indispensables associés à des traitements fiables et reproductibles.
L’assistance laser en parodontologie est efficace dans la décontamination des poches et s’inscrit parfaitement dans les principes de la parodontologie dite médicale.
Les controverses sont toutefois encore présentes et en particulier il n’a pas été démontré de façon indiscutable que cette assistance se montrait plus apte, que les méthodes traditionnelles à résoudre tous les problèmes.
BIBLIOGRAPHIE
1- Berglundh T, Gislason O, Lekholm U, Sennerby L, Lindhe J. Histopathological observations of human periimplantitis lesions. J ClinPeriodontol. 2004 May ; 31 (5) : 341-347.
2- Roos-Jansåker AM, Lindahl C, Renvert H, Renvert S. Nine to fourteen years follow-up of implant treatment. Part I : Presence of peri-implant lesions follow-up of implant treatment. Part II : Presence of peri-implant lesions. J Clin Periodontol. 2006 Apr; 33(4): 290-5.
3- Kao RT. Curtis DA, Murray PA. Diagnosis and management of periimplant disease. J Calif Dent Assoc 1997;25:872-880.
4- Cochran Dl, Hermann JS, Schenk RK, Higginbottom Fl, Buser D. Biologic width around titanium implants. A histometric analysis of the implanto-gingival junction around unloaded and loaded nonsubmerged implants in the canine mandible. J PeriodontoI1997;68:186-198.
5- Schroeder A, van der Zypen E, Stich H, Sutter F. The reactions of bone, connective tissue, and epithelium to endosteal implants with titaniumsprayed surfaces. J Maxillofac Surg 1981 ;9:15-25
6- Esposito M, Hirsch JM, Lekholm U, Thomsen P. Biological factors contributing to failures of osseointegrated oral implants. I. Success criteria and epidemiology. Eur J Oral Sci 1998;106:527-551.
7- Zablotsky MH, Kwan J. The surgical management of peri-implantitis: implant repair. In: Hall WB, Roberts WE, Labarre EE, eds. Decision making in dental treatment planning. Saint-Louis: Mosby, 1994.
8- I.K.Karoussis, G.E.Salvi, L.J.A.Heitz-Mayfield, U.Brägger, C.H.F.Hämmerle, N.P.Lang. Long-term implant prognosis in patients with and without a history of chronic periodontitis: a 10-year prospective cohort study of the ITI Dental Implant System. Clin. Oral Impl. Res. 14: 329-339, 2003.
10- Renvert S, Polyzois I, Maguire R, Re-osseointegration on previously contaminated surfaces: a systematic review. Clin Oral Implants Res. 2009 Sep;20 Suppl 4:216-27.
11- Ericsson I, Persson LG, Berglundh T. Edlund T, Lindhe J. The effect of antimicrobial therapy on periimplantitis lesions. An experimental study in the dog. Clin Oral Implants Res 1996;7:320-328.
12- Mombelli A, Muhle T. Bragger U, Lang Np, Burgin WB. Comparison of periodontal and peri-implant probing by depth-force pattern analysis. Clin Oral Implants Res 1997;8:448-454.
13- Kotsovilis S, Karoussis IK, Trianti M, Fourmousis I. Therapy of peri-implantitis : A systematic review. J. Clin. Periodontol. 2008 Juil;35(7):621-629.
14- Lindhe J, Lang NP, Karring T. Clinical periodontology and implant dentistry. Oxford: Black well Munksgaard; 2008.
15- Renvert S, Lessem J, Dahlén G, Renvert H, Lindahl C. Mechanical and repeated antimicrobial therapy using a local drug delivery system in the treatment of peri-implantitis: a randomized clinical trial. J. Periodontol 2008 May;79(5):836-44.
16- Bercy P, Tenenbaum H. Parodontologie : Du diagnostic à la pratique. Belgique : De Boeck Université; 1996.
17- Romeo E, Lops D, Chiapasco M, Ghisolfi M, Vogel G. Therapy of peri-implantitis with resec-tive surgery. A 3-year clinical trial on rough screw-shaped oral implants. Part II: radiographic outcome. Clin Oral Implants Res. 2007 Avr;18(2):179-187.
18- Claffey N, Clarke E, Polyzois I, Renvert S. Surgical treatment of peri-implantitis. J. Clin. Pe-riodontol. 2008 Sep;35(8 Suppl):316-332.
19- Kreisler M, Gotz H, Duschner H: Effect of Nd:YAG, Ho:YAG, Er:YAG, CO2, and GaAIAs laser irradiation on surface properties of endosseous dental implants, Int J Oral Maxillofac Implants 17(2):202-211, 2002.
20- Lee JH, Heo SJ, Koak JY, et al: Cellular responses on anodized titanium discs after laser irradiation, Lasers Surg Med 40(10):738-742, 2008.
21- Romanos G, Crespi R, Barone A, Covani U: Osteoblast attachment on titanium disks after laser irradiation, Int J Oral Maxillofac Implants 21(2):232-236, 2006.
22- Matsuyama T, Aoki A, Oda S, et al: Effects of the Er:YAG laser irradiation on titanium implant materials and contaminated implant abutment surfaces, J Clin Laser Med Surg 21(1):7-17, 2003.
23- Schwarz F, Nuesry E, Bieling K, et al: Influence of an erbium, chromium–doped yttrium, scandium, gallium, and garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated titanium implant surfaces, J Periodontol 77(11):1820-1827, 2006.
24- Takasaki AA, Aoki A, Mizutani K, et al: Er:YAG laser therapy for peri-implant infection: a histological study, Lasers Med Sci 22(3):143-157, 2007.
25- Romanos GE, Nentwig GH: Regenerative therapy of deep peri-implant infrabony defects after CO2 laser implant surface decontamination, Int J Periodont Restorative Dent 28(3):245-255, 2008.
26- Walsh LJ: The current status of laser applications in dentistry, Aust Dent J 48(3):146-155, quiz 198, 2003.
27- Desmons S : Laser preconditioning in membranous bone site, 2008.
28- Nociti Júnior FH, Caffesse RG, Sallum EA, Machado MA, Stefani CM, Sallum AW. Clinical study of guided bone regeneration and/or bone grafts in the treatment of ligature-induced peri-implantitis defects in dogs. Braz Dent J. 2001;12(2):127-31.
29- Clark AE, Hench LL, Paschall The influennce of surface chemistry on implant interface histology: a theoretical basis for implant materials selection. J Biomed Mater Res. 1976 Mar;10(2):161-74
30- Mouhyi J, Dohan Ehrenfest DM, Albrektsson T. The Peri-Implantitis : Implant Surfaces, Microstructure, and Physicochemical Aspects. Clin Implant Dent Relat Res. 2009 Oct 16.

