

AO News #50
Juin 2022
Directrice de thèse : Elisabeth Dursun / Faculté : Paris V Descartes
L’utilisation des fluorures est reconnue et admise mondialement depuis près d’un siècle et a permis de faire reculer la prévalence de la maladie carieuse. Cependant leur utilisation reste hétérogène de par le monde et leur omniprésence soulève quelques questions. Dans ce travail de thèse, nous avons d’une part cherché à finement analyser les récentes recommandations et d’autre part mené une revue systématique de la littérature sur la toxicité potentielle des fluorures.
Un peu d’histoire…
Élément chimique de numéro atomique 9 et occupant cette même place dans le tableau périodique des éléments, le fluor, noté F et premier des halogénés, est un élément incontournable du monde qui nous entoure. Avec son électronégativité la plus importante (capacité à attirer les électrons lors d’une liaison chimique), il est toujours retrouvé à l’état combiné dans la nature. Extirpés des mines de spath-fluor et de cryolite il y a plusieurs milliers d’années, les fluorures ont longtemps été utilisés comme minéraux de décoration et en bijouterie dans leurs formes minérales stabilisées. Ce n’est qu’à la fin du 19e siècle que le chimiste français Henri Moissan découvre leur pouvoir conducteur et leur réactivité chimique (prix Nobel de 1906), en électrolysant une solution de fluorure de potassium.
En dentisterie, leur découverte révolutionne les traitements avec un nouvel aspect de prévention et de conservation des structures dentaires, et amène un axe de recherche sur leur utilisation topique et systémique. Toutefois, les Drs McKay, Black et Dean montrent que si l’émail exposé aux fluorures est plus résistant à l’attaque acide des sucres, il peut néanmoins se retrouver tacheté en cas de surdose pendant le développement dentaire. Cette altération, nommée fluorose, se limite à des taches crayeuses si le niveau d’exposition n’excède pas 1 ppm dans l’eau consommée. En 1945, Grand Rapids, dans l’état du Michigan est la première ville à fluorer son eau potable, et la cohorte révèle après 15 années de suivi que le taux d’atteinte carieuse de près de 30000 enfants scolarisés a chuté de près de 60 %. La fluoration de l’eau courante au XXème siècle est donc considérée comme une des plus grandes prises de décision et de réussite de santé publique. Cependant, l’utilisation systémique est désormais mondialement critiquée, notamment car les niveaux d’absorption et d’adsorption sont propres à chaque individu et extrêmement difficiles à contrôler.
De nos jours, ils sont largement utilisés : composition de médicaments, produits phytosanitaires, imagerie médicale, biocéramiques et biomatériaux fluorés, silicates fluorés en cosmétique, alimentation, pesticides et insecticides, fabrication des verreries, processus de nettoyage et purification des eaux usées et collectées, propulseurs aérosols, ustensiles de cuisine, revêtements imperméables, fabrication des engrais, du minerai de fer et de l’aluminium… Cette multiplicité des sources rend l’estimation du taux d’exposition par individu très difficile, et pose la question du respect de la limite réelle garantissant l’innocuité. Un apport en faible quantité (< 2,5 mg/j) aurait un impact prophylactique dentaire important, tandis qu’une ingestion plus importante (> 8 mg/j) pourrait être responsable de l’apparition de fluoroses dentaires et osseuses, ainsi que d’autres signes aigus de toxicité (1 mg/kg).
Intérêt et usage des fluorures
Intérêt potentiel de l’usage systémique
En Novembre 2018, l’EAPD réunit un groupe d’experts pour mettre à jour les recommandations d’usage des fluorures de 2009. L’EAPD recommande (grade faible/conditionnel) un apport systémique, comprenant lait – sel – tablettes/pastilles/gouttes, que pour des populations très ciblées, avec risque élevé d’atteintes carieuses et n’ayant pas accès à l’eau fluorée, et sans observance/accès à un brossage biquotidien au dentifrice fluoré. En revanche, la fluoration de l’eau courante est considérée comme une mesure publique sûre, efficace, pertinente et peu coûteuse de prévention de la maladie carieuse. L’EAPD reconnaît qu’elle n’est pas suffisante à elle seule et devrait être un élément important dans une approche préventive aux multiples facettes (incluant la promotion de la santé orale et des soins abordables). Elle reconnaît également la nécessité d’une surveillance continue de la population générale, vis à vis des effets sur la santé dentaire et générale, pour en assurer la sûreté, l’efficience et la pertinence.
Intérêt potentiel de l’usage topique
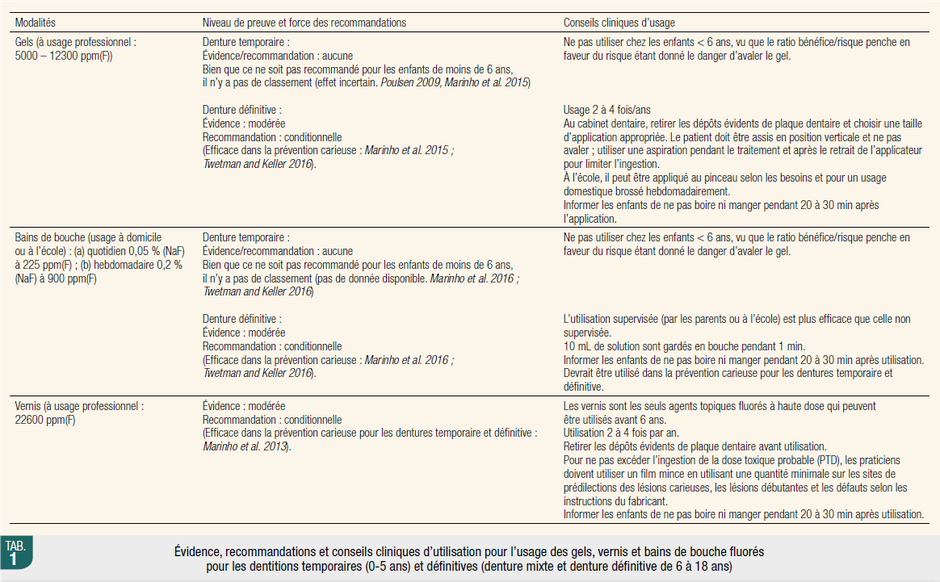
L’apport topique permet un effet préventif de la maladie carieuse (Marinho 2009 ; O’Mullane et al. 2016), mais aussi une action thérapeutique non invasive (sans restauration) en stoppant ou inactivant les lésions carieuses (Slayton et al. 2018 ; Urquhart et al. 2019). Il peut se faire via des : dentifrices, gels, vernis et bains de bouche. Ces trois dernières formules complémentent le dentifrice fluoré pour les enfants à RCI élevé, nécessitant des soins dentaires particuliers et spécialisés, en cours de traitements orthodontiques ou en période à risque comme l’éruption dentaire. Leur effet préventif apparaît plus important, en qualité et en quantité, pour les dents permanentes que pour les temporaires (Marinho et al. 2013, 2015, 2016 ; Twetman et Keller 2016). Chez les jeunes enfants (< 6 ans) à déglutition non mature, le risque d’ingestion (et donc de surdosage) est à peser avec le potentiel bénéfice.
L’utilisation des dentifrices fluorés, pratique, peu coûteuse, bien acceptée et intégrée culturellement, a fait l’objet de plusieurs revues systématiques ces deux
dernières décennies (Marinho et al. 2013 ; Twetman et al. 2003 ; Twetman 2009 ; Wong et al. 2011 ; Wright et al. 2014 ; Walsh et al. 2019), qui ont toutes confirmé son efficacité dans la
prévention de la maladie carieuse. Cependant, dans la récente revue systématique de Walsh et al. en 2019, l’efficacité significative du dentifrice fluoré vis-à-vis de la maladie carieuse n’est
montré que pour des concentrations supérieures ou
égales à 1000 ppm, ce qui nous amène à une réflexion : de telles concentrations sont-elles réellement adaptées pour des sujets en bas âge ? Selon le dernier rapport de l’EAPD, le risque de survenue de fluorose dentaire est en rapport avec les phases de sécrétion et maturation de la formation amélaire, avec une période de risque accru entre la naissance et 4 ans, une période de risque modéré entre 4 et 6 ans, et enfin une période avec un risque négligeable au-delà de 6 ans.
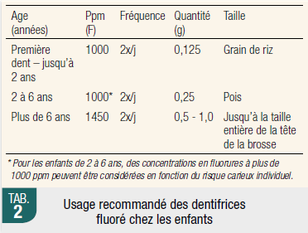
Le problème de l’utilisation du dentifrice fluoré (et autres topiques) chez les jeunes enfants est lié à l’ingestion (Wong et al. 2011). Le dentifrice fluoré pourrait être responsable de l’ingestion quotidienne jusqu’à 80 % de la dose optimale journalière recommandée, car les enfants de 1,5 à 2,5 ans avaleraient entre 64 et 84 % du dentifrice déposé sur la brosse à dents (Méjàre 2018, Cochran et al. 2004). Le brossage, au moins jusqu’à l’âge de 7 ans, doit être supervisé car les enfants n’ont pas de contrôle mature de leur réflexe de déglutition. Les dentifrices fluorés à moins de 1000 ppm semblent être une alternative raisonnable aux enfants régulièrement exposés à différentes sources de fluor, mais la preuve de leur efficience est limitée (Walsh et al. 2019).
Les concentrations recommandées ne sont pas réellement adaptées aux jeunes patients tant que les instructions d’utilisation, tant pour la méthodologie que la quantité, ne sont pas explicitées de manière claire et ludique (information accessible et compréhensible à tous les milieux socio-économiques) sur les packagings de ces produits. On peut toujours contrôler la quantité de fluorures présente et disponible dans une formulation, mais pas celle appliquée sur la brosse à dents dans les foyers. Déposer la quantité d’un grain de riz (ou d’un petit pois) sur une tête de brosse à dents, avec les conditionnements que nous connaissons tout n’est pas forcément facile. Une étude menée en 2013 montre que la plupart des parents en Allemagne, aux États-Unis et aux Royaume-Unis appliquent plus que 0,25 g (petit pois) sur la brosse à dents de leurs enfants de 3 à 6 ans (0,4 g pour Us et UK ; 0,6 g pour l’Allemagne). Les institutions de santé devraient astreindre les fabricants à présenter ces instructions sur les différents packagings.
Recommandations mondiales
Il est instructif de comparer les différentes recommandations dans le monde, et même celles de différentes institutions au sein d’un même pays. La France, suivant les recommandations de l’AFSSAPS et de la HAS, déconseille les apports systémiques de manière générale et limite leur utilisation à des cas très précis de patients, après étude individuelle approfondie aux différentes expositions, ce qui n’est pas le cas de l’Irlande (qui n’en recommande pas du tout) ou des organisations américaines (AAPD, ADA) qui appuient leur recommandation en fonction du taux de fluoration de l’eau commune.
En ce qui concerne les dentifrices fluorés, les recommandations divergent au point qu’on retrouve quasiment une recommandation par organisation/institution. Et fait marquant, la France est le seul pays à recommander le dentifrice fluoré inférieur ou égal à 500 ppm jusqu’à 6 ans. L’Écosse et le NHS recommandent, même pour des nourrissons à faible risque carieux, au moins 1000 ppm. Les recommandations des bains de bouche fluorés (concentration généralement de 230 ppm) sont plus homogènes et distinguent deux catégories d’âge : enfants de moins de 6 ans et ceux de 6 ans ou plus, âge charnière du risque d’ingestion. Pour les gels et vernis, les mêmes catégories d’âges sont définies, avec un âge limite de 6 ans, pour les mêmes raisons. Le gel est rarement recommandé, ou dans des conditions très particulières, du fait de sa viscosité plus importante qui pousse les patients à l’avaler. Les formulations couvrent un large spectre de concentrations en fluorures de 1000 à 56300 ppm.
Différents types de fluorures
Les ions fluorures « naturels » et « industriels » sont identiques dans leur structure, mais leur assimilation est différente. Les préparations artificielles sont réalisées avec de l’eau distillée tandis que les fluorures des océans ou rivières sont en présence de calcium et autres minéraux en quantité extrêmement élevée. Les préparations artificielles ont donc un potentiel d’activité chimique beaucoup plus important que les fluorures des eaux naturelles « stabilisés » par la présence de gros cations tels que le Ca2+ ou le Mg2+. Cependant, l’assimilation des fluorures industriels dans la circulation sanguine chez l’Homme peut être très bien tolérée pendant un certain temps, car l’os emprisonne efficacement ces chélateurs du calcium du liquide interstitiel pour minimiser l’exposition des tissus mous : l’os est le site de repos final de 95 % des fluorures absorbés (qui exercent de plus une stimulation ostéoblastique pouvant être à l’origine d’excroissances osseuses). Comme les fluorures ne sont pas des constituants de notre organisme, il n’existe pas de métabolisme endocrinien permettant de les mobiliser après fixation : c’est une action irréversible et pathologique. Ainsi, il peut affecter l’homéostasie calcique lorsqu’il s’accumule lentement et de manière permanente, car au pH extracellulaire, le fluoroapatite est insoluble. Les troubles vont d’un affaiblissement osseux léger et silencieux à des symptômes douloureux, jusqu’à l’immobilisation complète dans certains cas de fluoroses endémiques. Avant que les symptômes n’apparaissent, la fluorose ne peut être détectée que par des radiologues experts en la matière (Sauerheber, 2013). Avec l’âge, de moins en moins de liaisons sont libres dans les os pour stocker les fluorures et, avec une exposition continuelle, ils s’accumulent alors dans le cerveau (glande pinéale et hippocampe), les ligaments et tendons, les muscles, la thyroïde, les reins, le foie, l’aorte, le cœur...
Les principales molécules et composés retrouvés dans les dentifrices et autres préparations se rangent dans deux catégories les fluorures organiques (présence de C et d’H liés) ou inorganiques (composés sans C lié à l’H). Les fluorures présents dans l’air sont sous forme gazeuse ou particulaire et proviennent de la poussière des sols riches en F et des volcans, des activités industrielles et nucléaires, feux de charbon, utilisation de pesticides de masse etc. Les fluorures présents dans les eaux souterraines et de source dérivent de la cryolite, du spathfluor ou des phosphates rocheux comme l’apatite et leur concentration dépend de la région où on les retrouve (Scher 2011). Pour la fluoration de l’eau commune, les hexafluorosilicates et les acides hexafluorosiliciques sont les plus utilisés, et leur profil pharmacocinétique serait identique à celui du NaF (Scher 2011 ; Maguire et al. 2005 ; Whitford et al. 2008).
Les fluorures retrouvés dans la nourriture sont listés dans un rapport de l’EFSA en 2005 sur les niveaux d’exposition et d’ingestion tolérables. Si les taux de fluorures potentiellement ingérés y sont décrits, nous n’apprenons rien sur les formes et composés retrouvés dans la nourriture car les méthodes actuelles permettant d’isoler les fluorures passent par de la combustion et donc l’obtention de cendres qui dénaturent les structures originelles des aliments (EFSA 2005, FSAI 2018).
Les substances per- et polufluoroalkyles (PFASs) sont très fréquemment utilisées dans les revêtements anti-adhésifs, résistants à l’eau, aux taches, à la rouillure, à la graisse, dans les emballages alimentaires, dans les ustensiles de cuisine, les tapis, les meubles, les textiles, les équipements de performance extérieure, à la fabrication des fils dentaires… Étant donné leur utilisation répandue et leur nature persistante, il n’est pas surprenant que leur présence soit détectée dans l’eau, les sols (Zareitalabad et al. 2013) et l’organisme de quasiment tous les Américains (Kato et al. 2011). L’exposition aux PFASs et notamment au PFOA et au PFOS entraîne plusieurs problèmes uro-génitaux et intestinaux (Barry et al. 2013 ; Joensen et al. 2009 ; Steenland et al. 2013), ainsi que des affections thyroïdiennes et immunitaires (Grandjean et al. 2012 ; Lopez-Espinoza et al. 2012 et 2016). Le métabolisme de ces composés demeure incertain, peu étudié, et si les données ont tendance à montrer qu’ils sont très mal métabolisés avec une demi-vie plasmatique de plusieurs années chez l’Homme (INSERM 2011), leur hydrolyse avec libération d’un composé fluoré ou même d’ions fluorures reste possible.
Disponibilité réelle
Pour que le fluor soit efficace en bouche, il doit être chimiquement libre (ou soluble) dans la formulation du dentifrice. Cela assure sa biodisponibilité dans la cavité orale lors du brossage (Cury et Tenuta 2008). Les paramètres influençant la biodisponibilité vont être : la compatibilité chimique entre le type de fluorures et la molécule abrasive utilisée (le carbonate de calcium peut inactiver une partie des fluorures, Hattab 1989 ; Conde et al. 2003), la concentration en fluorures, le pH et la consistance (viscosité) (Buzalaf et al. 2009 ; Kondo et al. 2016).
Dose maximale de fluorures recommandables
La Commission Européenne fixe le niveau d’ingestion maximum tolérable à 0.1 mg/kg (poids corporel)/j soit 1.5 mg/j pour des enfants de 1 à 3 ans, 2.5 mg/j pour ceux de 4 à 8 ans, 5 mg/j pour ceux de 9 à 14 et 7 mg/j pour des individus de plus de 15 ans (Scher 2011). Cependant, aucune recommandation n’est faite pour les enfants de moins de 1 an, et le rapport déclare qu’en 1994, le UK Department of Health fixait la recommandation à 0.22 mg/kg/j comme sûre. En 2013, l’EFSA fixe sa limite acceptable ou ingestion adéquate (AI) à 0.05 mg/kg/j. L’EAPD recommande que le fluor ingéré ne devrait jamais excéder 0.07 mg/kg/j. L’ADA réaffirme en 2018 ses limites pour la dose acceptable à 0.05 mg/kg/j et la dose maximale à 0.10 mg/kg/j, toutes sources confondues.
Revue systématique de la littérature sur la toxicité générale des fluorures
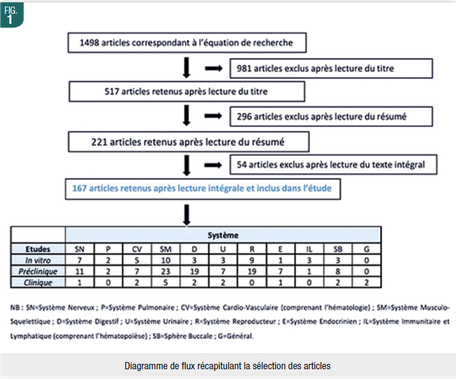
L’objectif est, via une revue systématique de la littérature, d’essayer de répondre aux questions suivantes : les fluorures auraient-ils des effets toxiques, cytotoxiques et génotoxiques sur les différentes cellules/ tissus du corps humain ? Si oui, à quelle concentration ?
Matériel et Méthode
La recherche documentaire a été réalisée exclusivement sur la base de données PubMed. Une unique mais détaillée équation de recherche a été libellée, après avoir sélectionné des mots clés, afin de recenser un maximum d’articles autour de notre problématique. Notre équation de recherche a été composée de deux parties, l’une concernant la notion de fluorures et l’autre, les notions de toxicité, qui ont été croisées, à savoir :
- le seul terme « fluoride » (pas de synonyme)
- tous les termes en rapport avec la toxicité mis en parallèle : « toxicity OR effects OR cytotoxicity OR genotoxicity »
Nous avons limité nos recherches aux articles contenant dans leur titre au moins le mot « fluoride » et l’un des mots en relation avec la toxicité, afin de réduire le nombre énorme d’articles et de cibler ceux précisément tournés vers l’évaluation de la toxicité des fluorures. Ainsi, l’équation de recherche entrée sur PubMed, pour recenser de manière exhaustive toutes les études permettant de répondre à notre problématique, a été : fluoride [Title] AND (toxicity [Title] OR effects [Title] OR cytotoxicity [Title] OR genotoxicity [Title]). Cette recherche a été menée initialement sans limite temporelle et arrêtée en avril 2020.
Pour être inclus, les articles devaient : être rédigés en langue française, anglaise ou allemande ; correspondre à une étude in vitro, ou in vivo animale ou humaine ; s’intéresser à un type cellulaire précis, un tissu, un organe ou un système ; mentionner un protocole clair de matériel et méthode ; comparer les groupes expérimentaux à un groupe contrôle.
Ont été exclus les articles : rédigés dans une autre langue que le français, l’anglais ou l’allemand ; de type « case report », « systematic review », « meta-analysis » ; centrés sur les effets bénéfiques des fluorures ; centrés sur les fluoroses dentaires et effets néfastes sur les améloblastes (fait acquis) ; dont l’objet d’étude se concentre sur un composé fluoré dont la toxicité est connue et renseignée ; dont l’étude consiste en une association de fluorures avec une ou plusieurs autres molécules ; dont l’objet d’étude est considéré comme trop éloigné de notre sujet ; dont ni le texte intégral ni lé résumé n’étaient accessibles ; étant des commentaires d’articles ou lettres de réaction ; publiés avant 1980.
Résultats
Le processus de tri et sélection des articles est détaillé dans le diagramme de flux (Fig. 1). Nous allons présenter les résultats par système.
En préambule à la présentation des résultats issus des articles retenus, plusieurs points à noter.
- Les auteurs utilisant des unités différentes, rappelons que :
1 ppm = 1 mg/kg donc 1 ppm = 1 mg/L (pour les solutions diluées dans l’eau)
1 mM = 1 mmol/L
1 mg/L = 1 mM x (masse moléculaire).
- Afin de faciliter la lecture et la comparaison entre les études, nous rapporterons pour chacune d’elle lorsqu’il s’agit d’une exposition à partir d’une solution, les valeurs approximatives en mg/L.
- Sauf mention contraire, pour chaque étude, l’exposition correspond in vitro au milieu cellulaire et in vivo à l’eau de consommation.
- Il est important de noter, que les rongeurs sont plus efficaces que les humains pour évacuer les fluorures de leur corps (Angmar-Månsson et Whitford) et que des rats exposés à 50-100 mg (NaF)/L présentent les mêmes niveaux de fluorures sériques que des humains exposés à 1-5 mg (F-)/L (Lyaruu et al. ; Singh et al., Yan et al.), ce qui correspond aux chiffres retrouvés fréquemment dans les environnements naturels en Europe, Amérique, Asie et Afrique (Mumtaz et al.). Ainsi, même si les doses d’exposition semblent particulièrement élevées dans les études in vitro ou in vivo animales, elles permettent de simuler les conséquences pour des doses d’exposition quotidienne chez l’homme.
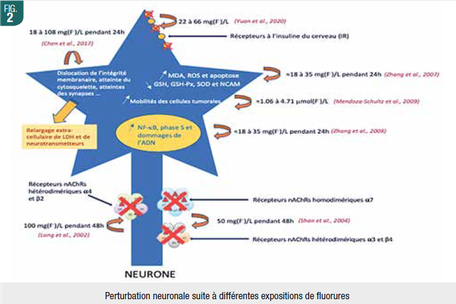
Système nerveux (Fig. 2)
Les fluorures induiraient dans les tissus nerveux, selon l’exposition, une augmentation du stress oxydatif traduite par des souffrances cellulaires (augmentation EC de LDH), une augmentation des ROS, MDA et taux d’apoptose, ainsi que des perturbations des facteurs anti-oxydatifs (SOD, GSH, GSH-Px...). Ils induiraient des dégénérescences structurelles cytoplasmiques, membranaires et nucléaires, telles que des diminutions de l’attache cellulaire, des récepteurs neuronaux de l’insuline et de l’acétylcholine, de la plasticité́ synaptique et dendritique, des perturbations des processus d’autophagie essentiels à un développement sain des tissus nerveux, qui se traduiraient chez l’Homme par une diminution significative du quotient intellectuel.
Système pulmonaire
Les fluorures seraient à l’origine, dans les tissus pulmonaires, selon l’exposition, d’une augmentation du stress oxydatif, traduit par l’augmentation des ROS et des niveaux de MDA et par la diminution ou l’inhibition des facteurs anti-oxydants (CAT, SOD, GSH...) et des pompes protoniques essentielles au bon fonctionnement cellulaire (Na+K+ATPase, Ca2+ATPase). Ceci a pour effet de perturber la synthèse macromoléculaire d’ADN, d’ARN et de protéines, d’activer des voies pro-apoptotiques (caspases, Bcl, JNK) et de d’inhiber ou diminuer les voies de prolifération cellulaire (ERK).
Système cardio-vasculaire (Fig. 3)
Les fluorures provoqueraient des effets biphasiques dépendants de la concentration d’exposition au niveau cardiaque, notamment sur les paramètres anti-oxydatifs : une exposition de 4.4 ppm (F-) induirait une stimulation des SOD, CAT et GPx tandis qu’une concentration supérieure à 22 ppm les inhiberait. De plus, ils auraient un effet inhibiteur sur la conformation fondamentale de la pompe CA2+ATPase, qui joue un rôle clé dans la capacité de contraction cardiaque. Enfin, des dommages importants sur les différentes cellules sanguines ont été observés à différentes expositions, se traduisant cliniquement, entre autres, par une inhibition de la glycolyse érythrocytaire humaine. La toxicité des fluorures n’est pas toujours dose-répondante et dépend de la concentration sanguine en calcium qui présente une grande variabilité individuelle.
Système squelettique et musculo-articulaire
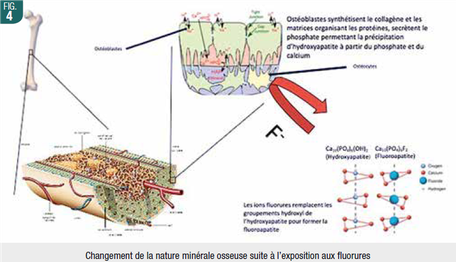
Les fluorures entraîneraient dans les tissus musculaires et osseux des altérations de la locomotion en fonction de l’exposition. Des inhibitions des ostéoclastes et des nodules ostéoïdes (par diminution de la minéralisation) sont obervées. Selon l’exposition, les précurseurs osseux et ostéoblastes peuvent être stimulés ou inhibés, mais leur stimulation induit la formation de fluoroapatite (Fig. 4) qui produit un os moins minéralisé avec réduction du collagène (type I), plus susceptible aux fractures. Ils affectent la production et la dégradation des matrices EC osseuses pendant les phases précoces de minéralisation et diminuent l’expression des facteurs anti-oxydants. Enfin, un verrouillage nucléaire, entraînant des sur-expressions, déséquilibre l’homéostasie osseuse et donc plusieurs paramètres généraux.

Système digestif
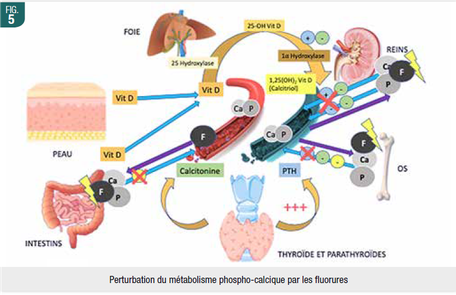
Les fluorures induiraient dans le système digestif, selon l’exposition, une augmentation du stress oxydatif et des facteurs apoptotiques en diminuant les facteurs anti-oxydants et en perturbant les transports ioniques dans les organes digestifs. Des lésions histopathologiques dues à la corrosivité des fluorures sont observées aux niveaux gastriques, intestinaux et hépatiques. En outre, l’exposition aux fluorures perturberait l’homésotasie phospho-calcique en précipitant ces minéraux essentiels au fonctionnement normal du corps (Fig. 5).
Système urinaire
L’exposition aux fluorures seraient responsable d’altérations du mitochondrion dans les cellules rénales collectrices et affecteraient les transporteurs et pompes ioniques dans les tissus rénaux. Elle augmenterait aussi la peroxydation lipidique et les dommages oxydatifs en perturbant l’homéostasie phospho-calcique au niveau rénal (Fig. 6). Les reins seraient donc des cibles moléculaires de l’exposition aux fluorures, et ces derniers pourraient être à l’origine des Insuffisances Rénales Chroniques d’origine inconnue (IRCi).

Système reproducteur
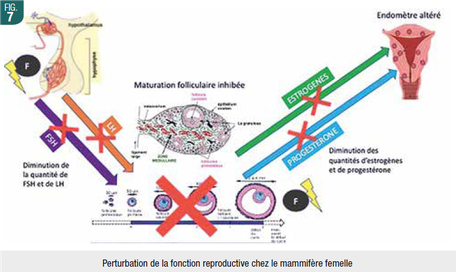
Les fluorures induiraient une diminution de la prolifération des cellules germinales par inhibition de la synthèse protéique et par diminution de la production des hormones de reproduction. Ils provoqueraient des défauts structurels et ultra-structurels dans les testicules, ovaires et utérus (Fig. 7), ainsi que des inhibitions enzymatiques dans les spermatozoïdes et ovules, et empêcheraient des développements et activations efficaces à l’origine des capacités de fertilisation. Enfin, ces organes de reproduction voient les dommages oxydatifs augmenter et leurs paramètres anti-oxydants diminuer après ces différentes expositions aux fluorures.
Système endocrinien
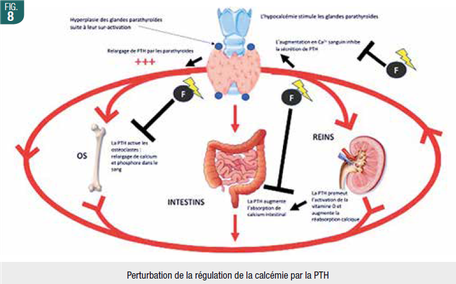
Les fluorures induiraient des altérations structurelles de la thyroïde et des parathyroïdes et inhiberaient la sécretion de PTH par des mécanismes complexes, perturbant l’équilibre phospho-calcique général (Fig. 8). Des sur-expressions de certaines oxydo-réductases thyroïdiennes diminueraient la sécretion des hormones thyroïdiennes. Des enzymes essentielles telles que l’AChE ou la phosphatase alcaline seraient diminuées suite à l’augmentation de la peroxydation lipidique dans les tissus endocriniens.
Système immunitaire et lymphatique
Les fluorures provoqueraient une inhibition partielle de la voie p38MAPK ayant un rôle essentiel dans la mise en place de l’immunité splénique. Ils seraient à l’origine d’une augmentation des dommages oxydatifs et d’une diminution de l’activité mitochondriale des macrophages, et pourraient altérer le cycle cellulaire et l’expression protéique cytokinaire des lymphocytes.
Sphère buccale
Les fluorures induiraient une diminution de la prolifération cellulaire pulpaire et leur toxicité serait corrélée à la baisse du pHEC. Ils altéreraient les fibroblastes en s’accumulant dans leur cytoplasme et seraient à l’origine d’augmentation du stress oxydatif dans les glandes submandibulaires. Ils augmenteraient aussi l’épaisseur du condyle mandibulaire (réduisant l’espace disponible dans l’ATM et donc les échanges trophiques nécessaires à son bon fonctionnement) et retarderaient les processus de cicatrisation osseuse en diminuant et retardant la minéralisation de la matrice osseuse.
Discussion
Cette revue de littérature n’a pas vocation à remettre en question les bénéfices topiques potentiels apportés par les fluorures, mais d’attirer l’attention sur l’exposition quotidienne à laquelle nous sommes confrontés. Les produits d’hygiène dentaire présentent des taux importants de fluorures et leur ingestion répétée et non surveillée pourrait avoir des effets délétères et silencieux sur notre santé. La découverte d’accumulation de fluorures en excès dans le corps peut se faire fortuitement (calcifications pinéales ou vertébrales après examens d’imagerie) ou après manifestation de symptômes de fluorose, auquel cas, il est malheureusement déjà trop tard.
Même si nous avons converti toutes les expositions dans la même unité, il reste difficile de synthétiser et comparer tous les résultats obtenus, compte tenu de la grande variété des conditions expérimentales pour les études in vitro et de la grande variété des espèces pour les études précliniques. Certaines études pointent du doigt le fait que des concentrations en fluorures excessivement proches peuvent avoir des effets radicalement opposés : un effet de stimulation peut être optimal ou maximal à une concentration donnée et devenir toxique à la centésimale ou décimale suivante. Ainsi, ce phénomène rend aussi difficile l’estimation de la dose d’exposition tolérable pour chaque tissu et pour chaque effet.
Il ressort de la dense compilation de toutes ces études, que les fluorures peuvent affecter tous les systèmes et tissus de l’organisme. A noter que notre travail de revue systématique, s’est « limité » à scrupuleusement sélectionner les études bien menées et d’en ressortir l’essentiel, mais n’a pas donné́ lieu à une analyse du risque de biais de ces études.
Pour finir, un petit calcul concret. D’un point vue clinique, pour un enfant de 10 kg : en ingérant 50 g de dentifrice fluoré à 1000 ppm, ou 221 mL de bain de bouche à 0.05 % de NaF, ou encore 10,1 g de gel fluoré à 1,1 % de NaF, cet enfant aura ingéré 50 mg de fluorures ce qui correspond déjà à la dose toxique de 5 mg (F-)/kg (Shulman et al., 1997). Or, un petit tube de 15 mL de dentifrice, totalement avalable en deux brossages biquoditiens, pèse 25 g. Cette ingestion représente 50 fois la dose optimale pour cet enfant et la moitié de la dose toxique (aiguë). Sans compter l’exposition quotidienne générale (alimentation, eau, pollution, etc.). Il est donc clair, que l’utilisation de dentifrices ou produits fluorés à la maison doit être très sérieusement surveillée par un adulte averti. Les parents doivent donc être bien informés du risque de ces excès d’ingestion et prendre conscience du potentiel danger lié à une mauvaise utilisation des produits de prophylaxie dentaire. Or, même si les chirurgiens-dentistes en sont conscients, il faut réaliser à l’échelle de la population, notamment dans les milieux défavorisés, que les parents sont loin d’être tous sensibilisés au dépôt d’un grain de riz ou d’un petit pois de dentifrice sur la brosse à dent de leurs enfants. De plus, nous nous intéressons ici, seulement au danger lié aux fluorures ! N’oublions pas que les dentifrices contiennent aussi des lauryl-sulfates et autres produits non métabolisables qui s’accumulent définitivement dans le corps après ingestion.
REFERENCES BIBLIOGRAPHIQUES :
Alves, K. M., J. P. Pessan, M. A. Buzalaf, et A. C. Delbem. « Short communication : in vitro evaluation of the abrasiveness of acidic dentifrices ». European archives of paediatric dentistry 10, no Suppl 1 (2009): 43-45. https://doi.org/10.1007/BF03262700.
Angmar-Månsson, B., et G. M. Whitford. « Enamel fluorosis related to plasma F levels in the rat ». Caries research 18, no 1 (1984): 25-32. https://doi.org/10.1159/000260743.
Bardsley, A. « Health effects of water fluoridation : a review of the scientific evidence ». Office of the prime minister’s chief science advisor, 2014. https://thehub.swa.govt.nz/resources/health-effects-of- water-fluoridation-a-review-of-the-scientific-evidence/.
Barry, V., A. Winquist, et K. Steenland. « Perfluorooctanoic acid (PFOA) exposures and incident cancers among adults living near a chemical plant ». Environmental health perspectives 121, no 11-12 (2013): 1313-18. https://doi.org/10.1289/ehp.1306615.
Boronow, K. E., J. G. Brody, L. A. Schaider, G. F. Peaslee, L. Havas, et B. A. Cohn. « Serum concentrations of PFASs and exposure-related behaviors in African American and non-Hispanic white women ». Journal of exposure science & environmental epidemiology 29, no 2 (2019): 206-17. https://doi.org/10.1038/s41370-018-0109-y.
Buzalaf, M. A. R., J. P. Pessan, et K. M. R. P. Alves. « Influence of growth rate and length on fluoride detection in human nails ». Caries research 40, no 3 (2006): 231-38. https://doi.org/10.1159/000092231.
Buzalaf, M. A. R., F. V. Vilhena, F. G. Iano, L. Grizzo, J. P. Pessan, F. C. Sampaio, et R. C. Oliveira. « The effect of different fluoride concentrations and pH of dentifrices on plaque and nail fluoride levels in young children ». Caries research 43, no 2 (2009): 142-46. https://doi.org/10.1159/000211717. Cagetti, M. G., G. Campus, E. Milia, et P. Lingström. « A systematic review on fluoridated food in caries prevention ». Acta odontologica scandinavica 71, no 3-4 (2013): 381-87. https://doi.org/10.3109/00016357.2012.690447.
Cochran, J. A., C. E. Ketley, R. M. Duckworth, C. van Loveren, W. P. Holbrook, L. Seppä, L. Sanches, A. Polychronopoulou, et D. M. O’Mullane. « Development of a standardized method for comparing fluoride ingested from toothpaste by 1.5-3.5-year-old children in seven European countries. Part 2, Ingestion results ». Community dentistry and oral epidemiology 32, no Suppl 1 (2004): 47-53. https://doi.org/10.1111/j.1600-0528.2004.00139.x.
Conde, N. C. d. O., M. A. B. Rebelo, et J. A. Cury. « Evaluation of the fluoride stability of dentifrices sold in manaus, am, brazil ». Pesquisa odontologica brasileira 17, no 3 (2003): 247-53. https://doi.org/10.1590/s1517-74912003000300009.
Corrêa Rodrigues, M. H., J. R. d. Magalhães Bastos, et M. A. Rabelo Buzalaf. « Fingernails and toenails as biomarkers of subchronic exposure to fluoride from dentifrice in 2- to 3-year-old children ». Caries research 38, no 2 (2004): 109-14. https://doi.org/10.1159/000075934.
Creeth, J., M. L. Bosma, et K. Govier. « How much is a ’pea-sized amount’ ? : a study of dentifrice dosing by parents in three countries ». International dental journal 63, no Suppl 2 (2013): 25-30. https://doi.org/10.1111/idj.12074.
Cury, J. A., M. J. L. Oliveira, C. C. Martins, L. M. A. Tenuta, et S. M. Paiva. « Available fluoride in toothpastes used by Brazilian children ». Brazilian dental journal 21, no 5 (2010): 396-400. https://doi.org/10.1590/s0103-64402010000500003.
Cury, J. A., et L. M. A. Tenuta. « How to maintain a cariostatic fluoride concentration in the oral environment ». Advances in dental research 20, no 1 (2008): 13-16. https://doi.org/10.1177/154407370802000104.
European food safety authority. « Opinion of the scientific panel on dietetic products, nutrition and allergies (NDA) on a request from the commission related to the tolerable upper intake level of fluoride ». EFSA journal 3, no 3 (2005): 192. https://doi.org/10.2903/j.efsa.2005.192.
Fejerskov, O., J. A. Cury, L. M. Tenuta, et V. C. Marinho. « Fluorides in caries control ». In Dental caries : the disease and its clinical management, édité par O. Fejerskov, B. Nyvad, et E. Kidd, 3rd edition., 245-76. Oxford: Whiley, 2015.
Fejerskov, O., A. Thylstrup, et M. J. Larsen. « Clinical and structural features and possible pathogenic mechanisms of dental fluorosis ». Scandinavian journal of dental research 85, no 7 (1977): 510-34. https://doi.org/10.1111/j.1600-0722.1977.tb02110.x.
Finney, W. F., E. Wilson, A. Callender, M. D. Morris, et L. W. Beck. « Reexamination of hexafluorosilicate hydrolysis by 19F NMR and pH measurement ». Environmental science & technology 40, no 8 (2006): 2572-77. https://doi.org/10.1021/es052295s.
Food safety authority of Ireland. « Total diet study 2014–2016 : assessment of dietary exposure to fluoride in adults and children in Ireland », 2018. https://www.fsai.ie/publications/fluoride_study_2014-2016/.
Grandjean, P., E. W. Andersen, E. Budtz-Jørgensen, F. Nielsen, K. Mølbak, P. Weihe, et C. Heilmann. « Serum vaccine antibody concentrations in children exposed to perfluorinated compounds ». JAMA 307, no 4 (2012): 391-97. https://doi.org/10.1001/jama.2011.2034.
Hattab, F. N. « The state of fluorides in toothpastes ». Journal of dentistry 17, no 2 (1989): 47-54. https://doi.org/10.1016/0300-5712(89)90129-2.
Iheozor-Ejiofor, Z., H. V. Worthington, T. Walsh, L. O’Malley, J. E. Clarkson, R. Macey, R. Alam, P. Tugwell, V. Welch, et A.-M. Glenny. « Water fluoridation for the prevention of dental caries ». The Cochrane database of systematic reviews, no 6 (2015): CD010856. https://doi.org/10.1002/14651858.CD010856.pub2.
Institut national de la santé et de la recherche médicale. « Évolutions temporelles des altérations de la fonction de reproduction humaine : synthèse », 2011. http://www.ipubli.inserm.fr/bitstream/handle/10608/222/Synthese.html.
Jack, B., M. Ayson, S. Lewis, A. Irving, B. Agresta, H. Ko, et A. Stoklosa. « Health effects of water fluoridation : evidence evaluation report ». Canberra: National health and medical research council, 2016. https://www.nhmrc.gov.au/sites/default/files/documents/reports/fluoridation-evidence.pdf. Joensen, U. N., R. Bossi, H. Leffers, A. A. Jensen, N. E. Skakkebaek, et N. Jørgensen. « Do perfluoroalkyl compounds impair human semen quality? » Environmental health perspectives 117, no 6 (2009): 923-27. https://doi.org/10.1289/ehp.0800517.
Kato, K., L.-Y. Wong, L. T. Jia, Z. Kuklenyik, et A. M. Calafat. « Trends in exposure to polyfluoroalkyl chemicals in the U.S. population : 1999-2008 ». Environmental science & technology 45, no 19 (2011): 8037-45. https://doi.org/10.1021/es1043613.
Kondo, K/ Y/, M. A. R. Buzalaf, M. M. Manarelli, A. C. B. Delbem, et J. P. Pessan. « Effects of pH and fluoride concentration of dentifrices on fluoride levels in saliva, biofilm, and biofilm fluid in vivo ». Clinical oral investigations 20, no 5 (2016): 983-89. https://doi.org/10.1007/s00784-015-1583-4.
Levy, F. M., J. R. d. M. Bastos, et M. A. R. Buzalaf. « Nails as biomarkers of fluoride in children of fluoridated communities ». Journal of dentistry for children 71, no 2 (2004): 121-25.
Li, Y., G. R. Berenji, W. F. Shaba, B. Tafti, E. Yevdayev, et S. Dadparvar. « Association of vascular fluoride uptake with vascular calcification and coronary artery disease ». Nuclear medicine communications 33, no 1 (2012): 14-20. https://doi.org/10.1097/MNM.0b013e32834c187e.
Liang, C. « Epidemiological analysis of endemic Fluorosis in China ». Journal of environmental science and health 15, no 2 (1997): 123-38. https://doi.org/10.1080/10590509709373493.
Lopez-Espinosa, M.-J., D. Mondal, B. Armstrong, M. S. Bloom, et T. Fletcher. « Thyroid function and perfluoroalkyl acids in children living near a chemical plant ». Environmental health perspectives 120, no 7 (2012): 1036-41. https://doi.org/10.1289/ehp.1104370.
Lopez-Espinosa, M.-J., D. Mondal, B. Armstrong, B. Eskenazi, et T. Fletcher. « Perfluoroalkyl substances, sex hormones, and insulin-like growth factor-1 at 6-9 years of age : a cross-sectional analysis within the c8 health project». Environmental health perspectives 124, no 8 (2016): 1269-75. https://doi.org/10.1289/ehp.1509869.
Lyaruu, D. M., A. L. J. J. Bronckers, F. Santos, R. Mathias, et P. DenBesten. « The effect of fluoride on enamel and dentin formation in the uremic rat incisor ». Pediatric nephrology 23, no 11 (2008): 1973-79. https://doi.org/10.1007/s00467-008-0890-2.
Maguire, A., F. V. Zohouri, J. C. Mathers, I. N. Steen, P. N. Hindmarch, et P. J. Moynihan. « Bioavailability of fluoride in drinking water : a human experimental study ». Journal of dental research 84, no 11 (2005): 989-93. https://doi.org/10.1177/154405910508401104.
Marinho, V. C. C. « Cochrane reviews of randomized trials of fluoride therapies for preventing dental caries ». European archives of paediatric dentistry : official journal of the european academy of paediatric dentistry 10, no 3 (2009): 183-91. https://doi.org/10.1007/BF03262681.
Marinho, V. C. C., L. Y. Chong, H. V. Worthington, et T. Walsh. « Fluoride mouthrinses for preventing dental caries in children and adolescents ». The Cochrane database of systematic reviews 7 (2016): CD002284. https://doi.org/10.1002/14651858.CD002284.pub2.
Marinho, V. C. C., J. P. Higgins, A. Sheiham, et S. Logan. « Fluoride toothpastes for preventing dental caries in children and adolescents ». The Cochrane database of systematic reviews, no 1 (2003): CD002278. https://doi.org/10.1002/14651858.CD002278.
Marinho, V. C. C., H. V. Worthington, T. Walsh, et L. Y. Chong. « Fluoride gels for preventing dental caries in children and adolescents ». The Cochrane database of systematic reviews, no 6 (2015): CD002280. https://doi.org/10.1002/14651858.CD002280.pub2.
Mejàre, I. « Current guidance for fluoride intake : is it appropriate? » Advances in dental research 29, no 2 (2018): 167-76. https://doi.org/10.1177/0022034517750589.
Mumtaz, N., G. Pandey, et P. K. Labhasetwar. « Global fluoride occurrence, available technologies for fluoride removal, and electrolytic defluoridation: a review ». Critical reviews in environmental science and technology 45, no 21 (2015): 2357-89. https://doi.org/10.1080/10643389.2015.1025638. «Notice patient - FLUODONTYL 1350 mg, pâte dentifrice - Base de données publique des médicaments ». Consulté le 6 février 2021. http://base-donnees- publique.medicaments.gouv.fr/affichageDoc.php?specid=66929144&typedoc=N.
Olympio, K. P. K., P. a. P. Bardal, V. E. d. S. Cardoso, R. C. Oliveira, J. R. d. M. Bastos, et M. a. R. Buzalaf. «Low-fluoride dentifrices with reduced pH : fluoride concentration in whole saliva and bioavailability ». Caries research 41, no 5 (2007): 365-70. https://doi.org/10.1159/000104794. O’Mullane, D. M., R. J. Baez, S. Jones, M. A. Lennon, P. E. Petersen, A. J. Rugg-Gunn, H. Whelton, et G. M. Whitford. « Fluoride and oral health ». Community dental health 33, no 2 (2016): 69-99.
Richards, A., et D. W. Banting. « Fluoride toothpastes ». In Fluoride in dentistry, édité par O. Fejerskov, J. Ekstrand, et B. A. Burt, 2nd edition., 328-46. Copenhagen: Munksgaard, 1996.
Ricomini Filho, A. P., L. M. P. Tenuta, F. S. d. F. Fernandes, A. F. B. Calvo, S. C. Kusano, et J. A. Cury. « Fluoride concentration in the top-selling Brazilian toothpastes purchased at different regions ». Brazilian dental journal 23, no 1 (2012): 45-48. https://doi.org/10.1590/s0103-64402012000100008. Scientific commitee on health and environmental risks. « Critical review of any new evidence on the hazard profile, health effects, and human exposure to fluoride and the fluoridating agents of drinking water ». European Commission, 2011. https://data.europa.eu/doi/10.2772/38897
Silva, M. F., E. V. Melo, B. Stewart, W. De Vizio, J. L. Sintes, M. E. Petrone, A. R. Volpe, Y. Zhang, J. J. McCool, et H. M. Proskin. « The enhanced anticaries efficacy of a sodium fluoride and dicalcium phosphate dihydrate dentifrice in a dual-chambered tube : a 2-year caries clinical study on children in Brazil ». American journal of dentistry 14, no Special number (2001): 19A-23A.
Singh, N., K. G. Verma, P. Verma, G. K. Sidhu, et S. Sachdeva. « A comparative study of fluoride ingestion levels, serum thyroid hormone & TSH level derangements, dental fluorosis status among school children from endemic and non-endemic fluorosis areas». Springerplus 3 (2014): 7. https://doi.org/10.1186/2193-1801-3-7.
Slayton, R. L., O. Urquhart, M. W. B. Araujo, M. Fontana, S. Guzmán-Armstrong, M. M. Nascimento, B. B. Nový, et al. « Evidence-based clinical practice guideline on nonrestorative treatments for carious lesions : a report from the American dental association ». Journal of the American dental association 149, no 10 (2018): 837-849.e19. https://doi.org/10.1016/j.adaj.2018.07.002.
Steenland, K., L. Zhao, A. Winquist, et C. Parks. « Ulcerative colitis and perfluorooctanoic acid (PFOA) in a highly exposed population of community residents and workers in the mid-Ohio valley ». Environmental health perspectives 121, no 8 (2013): 900-905. https://doi.org/10.1289/ehp.1206449. Sutton, M., R. Kiersey, L. Farragher, et J. Long. « Health effects of water fluoridation : an evidence review ». Health researchboard of Ireland, 2015. https://www.hrb.ie/fileadmin/publications_files/Health_Effects_of_Water_Fluoridation.pdf. Toumba, K. J., S. Twetman, C. Splieth, C. Parnell, C. van Loveren, et N. Α Lygidakis. « Guidelines on the use of fluoride for caries prevention in children : an updated EAPD policy document ». European archives of paediatric dentistry : official journal of the European academy of paediatric dentistry 20, no 6 (2019): 507-16. https://doi.org/10.1007/s40368-019-00464-2.
Tressaud, A. Le fluor : histoire, applications et paradoxes. Paris: CNRS éditions, 2011.
Twetman, S. « Caries prevention with fluoride toothpaste in children : an update ». European archives of paediatric dentistry: official journal of the European academy of paediatric dentistry 10, no 3 (2009): 162-67. https://doi.org/10.1007/BF03262678.
Twetman, S., S. Axelsson, H. Dahlgren, A.-K. Holm, C. Källestål, F. Lagerlöf, P. Lingström, et al. « Caries- preventive effect of fluoride toothpaste : a systematic review ». Acta odontologica scandinavica 61, no 6 (2003): 347-55. https://doi.org/10.1080/00016350310007590.
Twetman, S., et M. K. Keller. « Fluoride rinses, gels and foams : an update of controlled clinical trials ». Caries research 50, no Suppl 1 (2016): 38-44. https://doi.org/10.1159/000439180.
Urquhart, O., M. P. Tampi, L. Pilcher, R. L. Slayton, M. W. B. Araujo, M. Fontana, S. Guzmán-Armstrong, et al. « Nonrestorative treatments for caries : systematic review and network meta-analysis ». Journal of dental research 98, no 1 (2019): 14-26. https://doi.org/10.1177/0022034518800014.
Vidal France. « FLUOGEL 2000 mg gel dent ». In eVIDAL, 2021. https://ezproxy.u- paris.fr/login?url=https://evidal.vidal.fr/.
Walsh, T., H. V. Worthington, A.-M. Glenny, V. C. Marinho, et A. Jeroncic. « Fluoride toothpastes of different concentrations for preventing dental caries ». The Cochrane database of systematic reviews 3 (2019): CD007868. https://doi.org/10.1002/14651858.CD007868.pub3.
Whitford, G. M., et D. H. Pashley. « Fluoride absorption : the influence of gastric acidity ». Calcified tissue international 36, no 3 (1984): 302-7. https://doi.org/10.1007/BF02405334.
Whitford, G. M., F. C. Sampaio, P. Arneberg, et F. R. von der Fehr. « Fingernail fluoride : a method for monitoring fluoride exposure ». Caries research 33, no 6 (1999): 462-67. https://doi.org/10.1159/000016552.
Whitford, G. M., F. C. Sampaio, C. S. Pinto, A. G. Maria, V. E. S. Cardoso, et M. a. R. Buzalaf. « Pharmacokinetics of ingested fluoride : lack of effect of chemical compound ». Archives of oral biology 53, no 11 (2008): 1037-41. https://doi.org/10.1016/j.archoralbio.2008.04.001.
Wong, M. C. M., J. Clarkson, A.-M. Glenny, E. C. M. Lo, V. C. C. Marinho, B. W. K. Tsang, T. Walsh, et H. V. Worthington. « Cochrane reviews on the benefits/risks of fluoride toothpastes ». Journal of dental research 90, no 5 (2011): 573-79. https://doi.org/10.1177/0022034510393346.
Wright, J. T., N. Hanson, H. Ristic, C. W. Whall, C. G. Estrich, et R. R. Zentz. « Fluoride toothpaste efficacy and safety in children younger than 6 years : a systematic review ». Journal of the American dental association 145, no 2 (2014): 182-89. https://doi.org/10.14219/jada.2013.37.
Yan, N., Y. Liu, S. Liu, S. Cao, F. Wang, Z. Wang, et S. Xi. « Fluoride-induced neuron apoptosis and expressions of inflammatory factors by activating microglia in rat brain ». Molecular neurobiology 53, no 7 (2016): 4449-60. https://doi.org/10.1007/s12035-015-9380-2.
Yengopal, V., U. M. E. Chikte, S. Mickenautsch, L. B. Oliveira, et A. Bhayat. « Salt fluoridation : a meta- analysis of its efficacy for caries prevention ». Journal of the South African dental association 65, no 2 (2010): 60-64, 66-67.
Yeung, C. A., et M. Tickle. « Fluoridated milk for preventing dental caries in children and adolescents ». The Cochrane database of systematic reviews, no 3 (2002): CD003876. https://doi.org/10.1002/14651858.CD003876.
Yiamouyiannis, J. Fluoride the aging factor : how to recognize and avoid the devastating effects of fluoride. Delaware: Health Action Press, 1993.
Zareitalabad, P., J. Siemens, M. Hamer, et W. Amelung. « Perfluorooctanoic acid (PFOA) and perfluorooctanesulfonic acid (PFOS) in surface waters, sediments, soils and wastewater - a review on concentrations and distribution coefficients ». Chemosphere 91, no 6 (2013): 725-32. https://doi.org/10.1016/j.chemosphere.2013.02.024.
